di Umberto Mazzucchi
Prima parte
- La reazione di ipersensibilità
- Le membrane della cellula vegetale
- Esocitosi ed endocitosi in risposta immunitaria
Seconda parte
- Gli inneschi di morte
- I segnali di morte

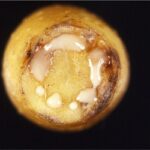
Foglia vite con peronospora – Pagina inferiore
Gli inneschi di morte
Perturbazioni locali di membrane costituite da pori consenzienti loro attraverso passaggio passivo di molecole tra comparto chiuso e ambiente esterno (apoplasto o citosol) sono spesso fattori scatenanti morte della cellula. Di norma la formazione di un poro in una membrana richiede l’intervento di una proteina appartenente alla famiglia delle “proteine formanti pori” (Pore Forming Proteins; PFPs) (10,35). Sono proteine (o polipeptidi) monomeriche, solubili in acqua, aventi come bersaglio membrane dove si aggregano tra loro formando oligomeri (oligomerizzano). Le PFPs possono essere endogene o esogene; quelle endogene, prodotte dalla stessa cellula, costituiscono segnali interni di risposta immunitaria per indurre la propria morte, quelle esogene provengono dall’esterno, di origine biotica o abiotica; ad esempio, certe tossine di patogeni, fattori di virulenza, sono riferite a PFPs. Sono proteine anfipatiche aventi porzioni (domini) idrofile e idrofobiche che, perturbando membrane, possono divenire inneschi di morte. L’integrità della membrana bersaglio vien meno quando la porzione idrofobica della proteina, spesso un solo dominio, si incunea per affinità entro lo spessore della membrana tra le catene idrofobiche dei lipidi (es. il dominio alfa1 della RNL ADR1) (Fig.4) La perturbazione si accentua quando altre molecole della stessa proteina si aggregano a quella iniziale associando le porzioni idrofile; in altre parole, si genera un oligomero inserito entro lo spessore della membrana avente al centro un attraversamento di diametro molecolare (poro) favorevole al passaggio di ioni o di piccole molecole idrofile (8).In realtà la dinamica della perturbazione è più complessa rispetto al modello appena descritto tanto da dar luogo a pori contornati solo da proteina o da proteina e lipidi (35).
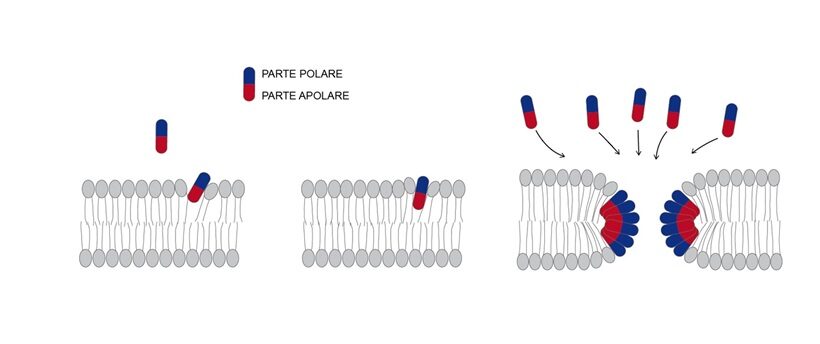
Fig.4 -Schema di perturbazione di membrana con formazione di poro a seguito della inserzione di un polipeptide o proteina anfipatica nel suo spessore e successiva sua oligomerizzazione con altri monomeri presenti con formazione di un poro idrofilo. Nella formazione dei resistomi immunitari sono particolari NLR associate o meno ad altre proteine a formare oligomeri pentameri letali inseriti nel plasmalemma.
Inneschi di morte riferibili a PFPs sono i peptidi antimicrobici prodotti dalle piante (40): sono molecole relativamente piccole (12-50 aa; 2-10 kD)) per lo più a carica positiva a pH fisiologico, stabili per presenza di ponti disolfuro, di cui tionine e difensine, le più note, derivano da proteine precursori non funzionali per degradazione enzimatica. Hanno proprietà di interagire con le membrane, incuneandosi nel loro spessore, oligomerizzare e dar luogo a pori o a gravi pertubazioni locali della loro struttura. Dal reticolo endoplasmatico o dal Golgi sono trasferite nel vacuolo dove si accumulano. La loro efficacia antimicrobica è tale da essere presi in considerazione per la messa a punto di farmaci per la lotta alle malattie dell’uomo, sostituendo antibiotici, e delle piante, escludendo quelle ad effetti indesiderati (es. allergie per l’uomo) (30).
I resistosomi, risultato di una risposta immunitaria scatenata da un effettore microbico critico (Rivista di Agraria N°364), causano di fatto perturbazioni di membrana; sono oligomeri di proteine NLR, sensori o helper, e proteine particolari, che si insinuano nello spessore del plasmalemma o della membrana di un organulo citoplasmatico creando pori causanti flussi tra citoplasma e apoplasto o tra spazio interno dell’organulo e citoplasma. Certi oligomeri tetrameri hanno proprietà enzimatiche attive su NAD generando molecole segnale immunitarie (26).
La cellula ha comunque la possibilità di riparare i danni causati da certe perturbazioni sulle sue membrane, in particolare sul plasmalemma, mediante esocitosi e/o endocitosi mirate (3).
I segnali di morte
Si è visto come nella fase ETI della risposta immunitaria delle piante gli effettori dei patogeni siano riconosciuti all’interno delle cellule dai recettori NLR riferibili per lo più ai gruppi CNL, TNL e RNL (Rivista di Agraria N°364). Mentre CNL e TNL operano da sensori legandosi direttamente agli effettori, RNL sono ausiliari, operano a valle dei sensori, e generano segnali per il completamento della risposta. Le NLR hanno localizzazione intracellulare, possono associarsi al plasmalemma o a membrane del reticolo endoplasmatico, rimanere in citosol quando sovra-espresse (47).
In modelli correnti si ammette che una CNL, associata a particolari proteine attivatrici, leghi l’effettore riconosciuto incompatibile (cioè prodotto da un ceppo avirulento di un patogeno) e formi un oligomero pentamero inserito nel plasmalemma avente un poro centrale, cioè un resistosoma, causante flusso di ioni Ca2+dall’apoplasto al citoplasma per gradiente favorevole di concentrazione (da mM a nM). L’incremento di concentrazione di ioni calcio nel citoplasma è il segnale a valle della CNL tale da attivare vie metaboliche potenzianti la PTI o rendere incontrollabile la omeostasi cellulare e indurre morte della cellula. Il modello fa comunemente riferimento alla CNL ZAR1 di A. thaliana capace di riconoscere una serie di effettori batterici (4). Il Ca+2è tossico per la cellula perché si lega ai gruppi carbossilici e fa precipitare ATP e pirofosfati tanto che in situazioni di citosol in quiete la sua concentrazione è mantenuta molto bassa, a circa o meno di 100 nM; dato che entro gli organuli la concentrazione è alta (Rivista di Agraria N°379), l’equilibrio è mantenuto con pompe a consumo di energia, a spese di ATP, in modo che il gradiente nelle loro membrane sia negativo a 100-300 mv (19,45).
Più complessa è la risposta immunitaria quando un effettore incompatibile è riconosciuto da TNL che, associate in un resistosoma tetramero o singolarmente, danno avvio ad una attività catalitica su NAD, ATP e DNA, RNA rispettivamente con produzione di una serie di piccole molecole, di cui quattro si ritiene promuovano l’aggregazione di coppie di proteine con formazione di dimeri (EDS1/PAD4) e (EDS1/SAG101) e successivamente di trimeri; per le restanti piccole molecole il ruolo non è ancora definito. I trimeri EDS1/SAG101/ADR1 e EDS1/SAG1/NRG1 (dove ADR1 e NRG1 sono RNL) genererebbero resistosomi associati al plasmalemma aventi effetti mortali per la cellula (11,17,18,47). Un modello recente in A. thaliana propone che la RNL NRG1, poco prima dell’inizio di ETI, sia già attivata, legata col suo dominio LRR, via cariche negative, a fosfolipidi del plasmalemma e della membrana del reticolo endoplasmatico. Ulteriore attivazione di NRG1 da fattore non ancora definito causerebbe l’inserimento del suo dominio α1 tra le catene dei fosfolipidi delle membrane. Successiva oligomerizzazione darebbe luogo a un resistosoma letale costituito, secondo gli autori, dalle sole NRG1(47). In questo modello la RNL NRG1 attivata diventerebbe un innesco di morte analogamente ad una proteina formante pori (PFP). Invece un altro trimero EDS1/PAD4/NRG1 avvierebbe trascrizioni nel nucleo e risposte immunitarie riferibili a PTI, confermando pertanto la integrazione ETI-PTI (Fig.5).
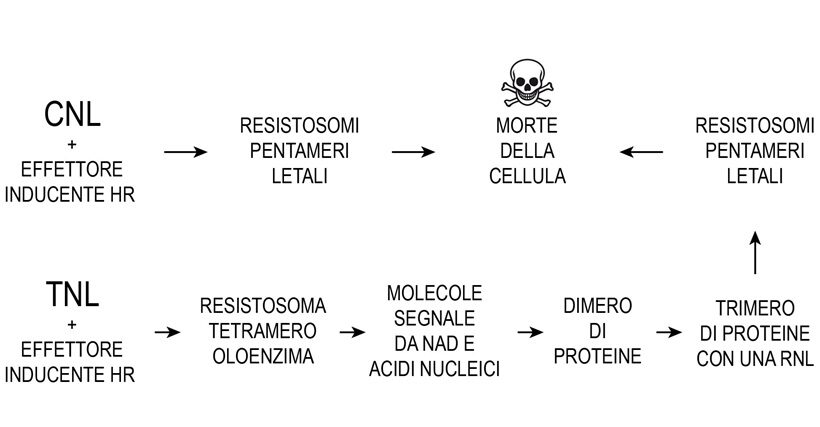
Fig.5 – Schema delle tappe principali della risposta immunitaria ipersensitiva culminante con la morte della cellula vegetale secondo modelli correnti.
La generazione dei segnali di morte attiva autofagia sia nelle cellule ipersensibili che in quelle normali dei tessuti limitrofi: per le une segna il punto di non ritorno per la morte, per le altre normale azione protettiva per la conservazione in vita (42).
I segnali per la morte ipersensitiva delle cellule si generano dunque all’inizio di ETI quando ha luogo il riconoscimento di un effettore incompatibile del patogeno da parte di una NLR critica, sensore o ausiliaria, con formazione di resistomi causa di gravi perturbazioni locali di membrane. Più spesso il plasmalemma è indicato come bersaglio delle perturbazioni, ma non si può escludere possano essere coinvolte anche membrane di organuli citoplasmatici, da cui possono parimenti aver luogo flussi destabilizzanti di Ca+2 in citoplasma.
Facendo riferimento a sistemi sperimentali appropriati è possibile conoscere gli eventi citologici e macroscopici della risposta ipersensitiva, di cui poc’anzi sono state descritte interazioni molecolari. La fitobatteriologia ha offerto in passato su tabacco e offre tuttora su Arabidopsis i modelli più informativi.
Una area fogliare di tabacco infiltrata negli spazi intercellulari con sospensione di un batterio incompatibile (˃5.106 batt./ml) diviene ipersensitiva. Dopo 2-3 ore dalla infiltrazione, dalle cellule dell’area c’è efflusso di elettroliti (12). Dopo circa 4 ore il tessuto perde turgore, nelle ore successive collassa e poi dissecca. Dopo 24 ore si ha necrosi confluente se almeno 25% delle cellule dell’area sono morte (Fig.6). Un singolo batterio è sufficiente a causare la morte di una cellula. Perdita di turgore è un vistoso segnale visibile indicante drammatico calo della pressione idrostatica interna del vacuolo con fuoriuscita di liquido in citoplasma e apoplasto. A 6 ore dalla infiltrazione dei batteri, micrografie elettroniche mostrano presenza di gravi danni sia al plasmalemma che al tonoplasto e ad altre membrane incluse quelle dei cloroplasti (12,13). Ammettendo che la risposta ETI inizi dopo circa 2 ore di interazione con il patogeno e si esprima in modo compiuto tra 3 e 6 ore (23), l’effetto funesto dei resistosomi immunitari potrebbe aver luogo dopo circa 4-5 ore in corrispondenza dell’inizio perdita di turgore visibile del tessuto. Ad omeostasi incontrollata, i collassi di tonoplasto e plasmalemma associati alla inevitabile morte delle cellule causerebbero fuoriuscita del contenuto vacuolare antimicrobico in apoplasto bloccando l’infezione batterica.

Fig.6 -Necrosi confluente ipersensitiva in 4 aree internervali di foglia di tabacco infiltrate 24 ore prima con sospensioni in acqua distillata di batteri fitopatogeni incompatibili (108b/ml) (a destra). Con sottile ago la sospensione è stata iniettata negli spazi intercellulari delle aree internervali (a sinistra). Il colore verde scuro della area internervale è conseguenza degli spazi intercellulari pieni di liquido.
Analoghe infiltrazioni fogliari rendono ipersensitivi anche i tessuti di Arabidopsis. (16,38). Dopo 9 ore di interazione con un batterio incompatibile micrografie elettroniche mostrano fusione del tonoplasto con il plasmalemma associata alla formazione qua e là di ampi pori. Gli enzimi litici e le sostanze antimicrobiche vacuolari versati drammaticamente in apoplasto attraverso i pori bloccherebbero le infezioni dei batteri incompatibili. Questa “sorta di esocitosi” drammatica e anomala, associata alla morte della cellula, costituirebbe la reazione di difesa immunitaria ipersensitiva mirata ai batteri viventi negli spazi intercellulari (Rivista di Agraria N°352, Fig.4). Alla osservazione visiva, il tessuto infiltrato con la sospensione dopo 4-5 ore perde turgore e poi collassa; le cellule coinvolte muoiono e nelle ore successive il tessuto dissecca; evoluzione simile a quella delle foglie di tabacco, dove però non è stata descritta fusione delle due membrane il cui collasso porta a morte la cellula. Nonostante la loro stretta contiguità fisica (Fig.1), nella cellula vivente in condizioni di normalità fusioni tonoplasto/plasmalemma con formazione di pori sono drasticamente inibite, sebbene siano favorite da tensione e curvatura del tonoplasto disteso per l’alta pressione interna (33,41). Di fatto, fusione e pori causerebbero immediato collasso del vacuolo e morte delle cellule. Mentre esocitosi vacuolo-plasmalemma sono note, rare sono le descrizioni di versamenti diretti dall’uno altro, anche in tessuti secretori, dove quando avvengono coinvolgono vacuoli di limitate dimensioni (44). Il versamento di sostanze antibatteriche in apoplasto ha luogo comunemente via vescicole di esocitosi generate dal reticolo endoplasmatico o dal Golgi –trans con fusioni mediate da SNARE tra le loro membrane e il plasmalemma, con preliminare aggancio delle due membrane dal complesso proteico ottamero esocisti (9). La “fusione anomala” tonoplasto/plasmalemma con formazione di ampi pori suggerisce intervento in loco di fusogeni assai efficienti, endogeni e/o esogeni, generati già nelle prime 3 ore di interazione, tempo di inizio osservazione della fusione in parola e di presenza di materiale proteico antibatterico versato fuori dalle cellule in apoplasto (15). L’attività proteolitica espressa in loco in grado di rimuovere l’inibitore della fusione tonoplasto/plasmalemma (es. PBA1 caspasi-simile) (32) associata a presenza di proteine di patogenesi e/o di peptidi antimicrobici accumulati nelle 3 ore di risposta immunitaria (PTI più inizio ETI) indicano anche possibile intervento di peptidi sulle due membrane, data la loro proprietà di indurre curvature negative favorevoli alle fusioni (21,25). L’ampia larghezza dei pori può essere conseguenza della tensione sulle due membrane per la pressione interna del vacuolo. Non si può escludere tra l’altro intervento di effettori batterici come fusogeni.
La presenza del complesso proteico AP-4 s’è dimostrata correlata positivamente all’evento fusione tonoplasto/plasmalemma e alla formazione degli ampi pori (16). Di fatto il numero di pori nel tessuto mutante senza AP-4 è risultato assai inferiore rispetto al tessuto normale. AP-4 è un complesso proteico etero-tetramero, adattatore (“portabagagli”) perivescicolare, selettore di proteine da accogliere in vescicole di esocitosi, trasportare e scaricare oltre il plasmalemma. La proteina ATG9, promotrice delle prime tappe di autofagia negli eucarioti, si lega ad AP-4 ed è guidata in vescicola per il trasporto in esocitosi (27,28). È plausibile che la presenza di AP-4 sia connessa alla necessità di avviare autofagia sia nelle cellule ipersensitive che in quelle normali, limitrofe e distanti, mediante il segnale ATG9. Di fatto, l’autofagia per le cellule è da ritenersi strumento di morte e di vita per la sua capacità di degradare selettivamente i regolatori positivi e negativi di morte programmata (24,29).
Nel caso di infezioni virali, dopo poche ore dalla inoculazione, i segnali di morte comportano collasso e lisi del tonoplasto (43) e versamento nel citoplasma del contenuto vacuolare, costituito da enzimi degradativi (proteasi e nucleasi) e proteine di patogenesi e polipeptidi antimicrobici, accumulatisi per endocitosi dal reticolo endoplasmatico, sede della loro sintesi; di particolare importanza gli enzimi a rifinitura vacuolare (Vacuolar Processing Enzymes; VPE) proteolitici, colà attivati da pervenute forme inattive. L’arrivo di enzimi litici nel citoplasma dove il virus sta svolgendo le proprie fasi di inoculazione comporta degradazione delle molecole virali, annientamento del virus e blocco della infezione. Destino analogo hanno le invaginazioni a membrana contenenti gli austori introdotte dai funghi nel citoplasma delle cellule ospiti (Rivista di Agraria N°352).
Lo studio della reazione di ipersensibilità sta senza dubbio contribuendo ad approfondire le nostre conoscenze sul sistema immunitario delle piante vascolari. Nell’ultimo ventennio il progresso è stato notevole.
Glossario
Omeostasi cellulare: la capacità di una cellula di mantenere ambiente interno stabile adatto a sostenere la vita al variare delle condizioni dell’ambiente esterno a seguito di stress biotici o abiotici.
Non-Self: Una biomolecola o un organismo che la pianta percepisce essere di diversa origine o in condizione differente dal normale, riconosciuti durante la propria attività metabolica per conservare la omeostasi.
DAMP: Molecola proveniente da cellule danneggiate o moribonde (es. eATP, eNAD, amminoacidi, oligogalatturonidi etc.). É riconosciuta dalle cellule normali come “non self”.
Stress: Ogni fattore esterno, o variazione di condizione, capace di allontanare significativamente la pianta dalla sua massima produttività; può agire in senso favorevole o sfavorevole (Matta A. et al., 1986).
Stress biotico: Causato da fattori biologici (es. patogeni)
Stress abiotico: Causato da fattori non biologici, fisici (es. t°) o fisico-chimici (es. pH, molecole organiche).
Biotrofo: un organismo che può vivere e moltiplicarsi solo su un altro organismo vivente.
Emibiotrofo: un organismo che vive solo una parte del suo ciclo (più spesso la prima parte) come biotrofo.
Necrotrofo:un organismo che uccide i tessuti mentre cresce loro attraverso e colonizza il substrato morto.
Apoplasto: Nei tessuti vegetali, tutto ciò che rimane all’esterno della membrana citoplasmatica (o plasmalemma) delle cellule (pareti, spazi intercellulari, trachee, tracheidi).
Simplasto: Nei tessuti vegetali, tutto ciò che rimane all’interno della membrana citoplasmatica: l’insieme dei protoplasti, collegati tra loro dai plasmodesmi, inclusi quelli dei tubi cribrosi del floema.
Citosol: La componente liquida e non strutturata del citoplasma, in cui sono immersi gli organuli (cloroplasti, mitocondri, etc.) e il citoscheletro della cellula vegetale.
Plasmalemma: Sinonimo di membrana citoplasmatica.
Tonoplasto: Denominazione della membrana del vacuolo.
AMP: Adenosina Monofosfato
ATP: Adenosina trifosfato; ADP: Adenosina difosfato;
NAD: Nicotamide adenina dinucleotide; NADH: Forma ridotta del NAD.
ROS: Forme reattive dell’ossigeno: anione superossido, acqua ossigenata, radicale idrossile, etc.
ATP: Adenosina trifosfato; ADP: Adenosina difosfato;
ROS: Forme reattive dell’ossigeno: anione superossido, acqua ossigenata, radicale idrossile, etc.
RBOHD: Acronimo di Respiratory Burst Oxidase Homolog D; Enzima NADPH Ossidasi forma D.
AMPK: Acronimo di AMP-activated protein kinase.
RIPK: Acronimo di Receptor-interacting protein kinase .
ETI: Acronimo di Effector-Triggered Immunity; Seconda fase della risposta immunitaria attivata dagli effettori.
PTI: Acronimo di Pattern-Triggered Immunity; Prima fase della risposta immunitaria attivata da recettori plasmalemma.
NLR: Acronimo di Nucleotide binding domain Leucine-rich repeat Receptor.
CNL: Acronimo di Coiled-coil Nucleotide -Binding site Leucine rich repeat -Tipo di NLR.
TNL: Acronimo di Toll/interleukin-1 receptor/resistance protein -Tipo di NLR.
RNL: Acronimo di Resistance to powdery mildew 8-like domain (RPW8) – Tipo di NLR.
SNARE: Acronimo di Soluble N-ethyl-maleimide-sensitive factor adaptor protein receptors.
Autofagia: Parte di citoplasma della cellula è rinchiusa in una vescicola a doppia membrana e trasferita nel vacuolo dove è digerita da enzimi idrolitici.
Effettore: Tutte le proteine e le piccole molecole (es. tossine) del patogeno che alterano la struttura e funzioni della cellula ospite. Le alterazioni possono facilitare l’infezione (fattori di virulenza) pur sollecitando risposte di difesa della pianta; in certi casi fino a bloccare l’infezione (fattori di avirulenza).
Lavori citati
1- Agmon E. e B.R. Stockwell, 2017. Current Opinion in Chemical Biology 39,83-89.
2- Allolio C. e D. Harries, 2021. ACS Nano 15,12880-12887.
3- Andrews N.W. e M. Corrotte,2018. Current Biology 28, R367-R420.
4- Bi G. et al., 2021. Cell 184,3528-3541.
5- Churchward M.A. et al.,2008. Biophysical Journal 94,3976-3986.
6- Clucas J. e P. Meier,2023. Nature Reviews Molecular Cell Biology,24,835-852.
7- Codjoe J.M. et al., 2022. The Plant Cell 34,129-145.
8- Cosentino K. et al.,2016. Biochimica et Biophysica Acta 1858,457-466.
9- De la Concepcion J.C.,2023. Current Opinion in Plant Biology76,102482.
10- Flores-Romero H. et al.,2020. The EMBO Journal 39,e105753,1-18.
11- Förderer A. et al.,2022. Current Opinion in Plant Biology 67,102212.
12- Goodman R.N. e A.J. Novacky,1994. The hypersensitive reaction in plants to pathogens. APS Press,244pp.
13- Goodman R.N. et al. 1986. The biochemistry and physiology of plant disease.376-379. Univ. Missouri Press.
14- Gronnier J. et al.,2018. Trends in Plant Science 23,10, 899-917.
15- Hatsugai N. et al.,2009. Genes & Development 23,2496-2506.
16- Hatsugai N. et al.,2018. Plant Physiology 176,1824-1834.
17- Huang S. et al.,2023. Trends in Biochemical Sciences 48,9,776-787.
18- Jia A. et al.,2023. Current Opinion in Plant Biology 73,102334.
19- Kleist T.J. e M.M. Wudick,2022. Current Opinion in Cell Biology 76,102080,1-7.
20- Kozlov M.M. e L.V. Chernomordik,2015. Current Opinion in Structural Biology 33,61-67.
21- Li J. et al., 2021. Botanical Studies 62,5,1-15.
22- Li P. et al., 2021. Molecular Plants 14,1652-1667.
23- Li P. et al.,2020. CRC Critical Review of Plant Science 39,1,72-100.
24- Liu Y. et al.,2005. Cell 121,567-577.
25- Mahlapuu M. et al., 2020. Critical Reviews of Biotechnology 40,7,978-992.
26- Maruta N. et al.,2023. Current Opinion in Plant Biology 73,102364.
27- Mattera R. et al., 2015.The Journal of Biological Chemistry 290,52,30736-30749.
28- Mattera R. et al.,2017. P.N.A.S. 27, E10697-E10706.
29- Minina E.A.et al.,2014. Trends in Plant Science 19,11,692-697.
30- Montesinos E., 2023. Annual Review of Phytopathology 61, 301-324.
31- Nicolson G.L.,2014. Biochemica et Biophysica Acta 1838,1451-1466.
32- Pajerowska-Muktar K. e X. Dong, 2009. Genes & Development 23,2449-2454.
33- Perez-Sancho J. et al.,2016. Trends in Cell Biology 26,9,705-717.
34- Robatsek S.,2007. Cellular Microbiology 9 (1),1-8.
35- Ros U. et al., 2021.Current Opinion in Structural Biology 69,108-116.
36- Scorrano L. et al., 2019. Nature Communications 101287.
37- Segev N. et al., 2018. Current Biology 28, R378-R380.
38- Shimada T. et al., 2018. Annual Review of Plant Biology 69,123-145.
39- Stakman E.C.,1915. Journal of Agricultural Research 4,193-199.
40-Tavormina P. et al., 2015. The Plant Cell 27,2095-2118.
41- Thompson W.W. et al.,1969. P.N.A.S.,63,310-317.
42-Üstün S. et al., 2017. Current Opinion in Plant Biology 40,122-130.
43- Van Doorn W.G. et al., 2011. Cell Death and Differentiation 18,1241-1246.
44- Vassiliev A.E. e A.A. Stepanova,1990. Journal of Experimental Botany 41,222,41-46.
45- Wang C. e S. Luan, 2024.Current Opinion Plant Biology 77,102485,1-10.
46- Wang J-Z. e K. Denesh, 2018. Current Opinion in Plant Biology 45,171-177.
47- Wang Z. et al., 2023. P. N. A. S. 120,32, e 222203610,1-11.
48-Wu B. et al., 2022. Molecular Plants 15,5, 887-903.
49- Wu B. et al., 2023.Trends in Plant Science 28,10,1124-1131.
50- Yang Y. e N.N. Margam, 2021.Cells 10,160,10010160,1-17. MDPI.
51- Zhang T. et al., 2023. Science 380,1372-1380.
52- Zheng H., 2021. Journal of Plant Physiology 266,153540,1-2.
Umberto Mazzucchi è stato professore ordinario di Patologia Vegetale alla Università degli Studi di Bologna dal 1989 al 2010. Docente del corso di Patologia Vegetale e di alcuni corsi specialistici di materie fitopatologiche, ha svolto ricerche sulle interazioni ospite-patogeno nel processo infettivo e sulla risposta immunitaria delle piante.
Pensionato dal 2010, come professore dell’Alma Mater ha svolto seminari occasionali e cicli di lezioni in corsi ufficiali della Università di Bologna.