di Umberto Mazzucchi
Prima parte
- La reazione di ipersensibilità
- Le membrane della cellula vegetale
- Esocitosi ed endocitosi in risposta immunitaria
Seconda parte
- Gli inneschi di morte
- I segnali di morte

Foglia vite con peronospora – Pagina superiore
La reazione di ipersensibilità
Nella fase ETI della risposta immunitaria ad agenti biotici gli effettori dei patogeni sono riconosciuti dai recettori NLR, proteine multidominio, riferibili per lo più ai gruppi CNL, TNL e RNL in base al dominio N terminale CC, TIR e RPW8-simile rispettivamente (Rivista di Agraria N°364) (Fig.1). È opinione corrente che CNL e TNL operino da sensori legandosi direttamente agli effettori; mentre RNL sarebbero ausiliari (helper) dei sensori, operando loro a valle e generando segnali per il completamento della risposta. Tra le risposte possibili evocate dalle CNL e soprattutto dalle RNL c’è la morte cellulare, strategia estrema di difesa, efficace nei confronti di patogeni biotrofici ed emibiotrofici, ma non necrotrofici, di cui in certi casi può divenire strumento di virulenza.
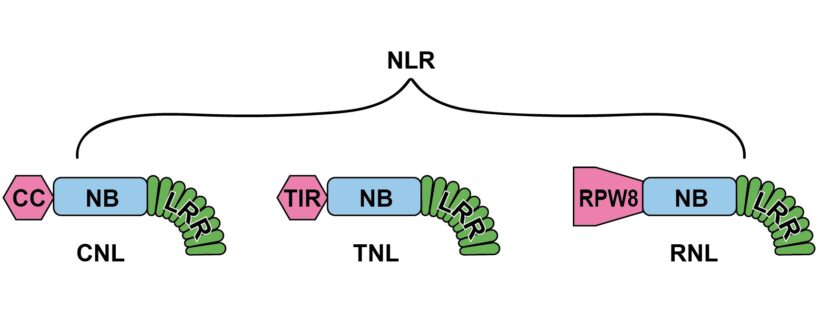
Fig.1– I tre tipi di NLR agenti nella fase di ETI della risposta immunitaria (dettagli in Rivista di Agraria N°364, Seconda parte) distinti in base al dominio N-terminale: CNL, TNL e RNL.
Di fatto, morte di cellule in certe situazioni è strategia di difesa immunitaria sia negli animali che nelle piante, con taluni meccanismi condivisi. Nelle piante questo tipo di risposta, descritta per la prima volta nel 1902 per la ruggine di bromi (Bromus spp.), caratterizzata da rapida morte delle cellule ospiti a contatto con gli austori del patogeno, fu denominata reazione di ipersensibilità (hypersensitive reaction,HR) (39). Fin da allora si constatò che la resistenza delle cultivar ad un patogeno era tanto più alta quanto più rapida era la risposta ipersensitiva (12).
Morte cellulare immunitaria può ritenersi forma di morte programmata assimilabile a quelle attuate dalle piante come risposte ad esigenze di differenziazione nel corso dello sviluppo e in risposta a stress abiotici (es. formazione di trachee e tracheidi; senescenza e abscissione delle foglie). Singole cellule morte, tuttavia, non sono visibili ad occhio nudo; divengono visibili solo gruppi di almeno 30-50 cellule morte associate sottoforma di areole puntiformi brune (es. punteggiature o macchiettature fogliari). Si deduce pertanto come morti immunitarie coinvolgenti poche cellule e propaguli di patogeni possano rimanere invisibili e l’organo della pianta asintomatico. Verosimilmente è il caso più frequente in natura.
La morte di una cellula fornisce informazioni ai sistemi immunitari delle cellule dei tessuti limitrofi sottoforma di segnali di allerta, più spesso DAMPs, per far fronte allo stato di stress causa della morte. È opinione recente che il livello energetico della cellula soggetta a stress, biotico o abiotico, sia cruciale; due chinasi sarebbero i punti chiave: AMPK e RIPK (6,22,48,49,51). AMPK sensore del calo di ATP cellulare con formazione di ADP a seguito di stress; RIPK sentinella critica dello stato di stress, interruttore molecolare governante la risposta immunitaria, fornitrice di NADPH (via NADP-ME2 citosolica) a RBOHD per la produzione di ROS (Rivista di Agraria N°362,380). La fosforilazione o meno di RIPK da parte di AMPK sarebbe decisiva per l’avvio a morte della cellula: RIPK inibita a seguito di fosforilazione in occasione di stress di breve durata orienterebbe a risposta immunitaria e sopravvivenza della cellula; RIPK attiva in presenza di stress perdurante, verso morte della cellula. La intensità e la durata dello stress sarebbero comunque decisivi per la sopravvivenza della cellula con messa in atto di barriere di difesa o per l’avvento di morte.
La morte di una cellula ha dunque luogo a seguito di sopraggiunta incapacità di preservare la propria omeostasi. I meccanismi letali avviati sono più spesso conseguenza di perturbazioni di membrane, anzitutto del plasmalemma e/o di altre membrane contornanti organuli citoplasmatici. La composizione e la complessa dinamica sotto stress delle membrane condizionano pertanto l’evento letale. La comprensione dei meccanismi ne richiede la conoscenza.
Le membrane della cellula vegetale
Nel corpo di una pianta tutte le membrane fanno parte del simplasto, delimitato dal plasmalemma (Fig. 2). In una cellula a completo sviluppo, attiva fisiologicamente, contornata da parete come quella di un parenchima, il volume è occupato per massima parte da un solo vacuolo (anche fino al 90%) e, in turgore, ha una pressione idrostatica interna rilevante (es. 0,44 MPa; 4,4 Bar), superiore anche a quella della gomma di un’auto (es.0,25MPa) (7). Sono di quest’ordine le pressioni che il simplasto di una cellula esercita col plasmalemma sulla sua parete. Per effetto della pressione vacuolare, citoplasma e i relativi organuli che contiene sono compressi in sottile strato contro la parete (Fig.2). Tra gli organuli, il reticolo endoplasmatico (RE) è un labirinto di tubuli di membrana interconnessi con tratti espansi a cisterna, altri appiattiti a fogli, in continuo divenire con formazione di nuovi tubuli, crescita e fusione di quelli esistenti, sede di sintesi e liberazione di proteine, di lipidi e di omeostasi del Ca2+; proteine ponte lo legano al citoscheletro (52). Nella cellula viva, matura, possiamo immaginare il reticolo come un groviglio di tubicini addossato alla parete e il citoplasma occupato da una sorta di fitta “ragnatela” di reticolo e citoscheletro con diramazioni in parete. Nella cellula normale turgida il potenziale idrico del citoplasma è uguale a quello del vacuolo e sul tonoplasto, membrana del vacuolo, possiamo ritenere non ci sia alcun stress meccanico o che comunque sia inferiore alla sua soglia di rottura. Tutti gli organuli del citoplasma [cloroplasti, mitocondri, perossisomi, reticolo endoplasmatico, cis– e trans-Golgi, nucleo sono contornati da membrane. Secondo il comune modello didattico una membrana di spessore circa 5-7nm è costituita da un doppio strato fosfolipidico con proteine inserite, integrali e periferiche (31). Il doppio strato presenta due facce idrofile (negative) in superficie (sopra e sotto) per presenza dei gruppi fosforici e due interne combacianti, idrofobiche, ognuna di spessore di circa 2-3 nm, dove ci sono le catene lipidiche (20). (Fig. 3). I lipidi delle membrane sono soggetti ad omeostasi (1) e la natura delle catene e la loro proporzione varia nel plasmalemma e nelle membrane degli organuli citoplasmatici. In realtà, la struttura e composizione delle membrane cellulari è assai più complessa rispetto al modello tradizionale didattico (14).
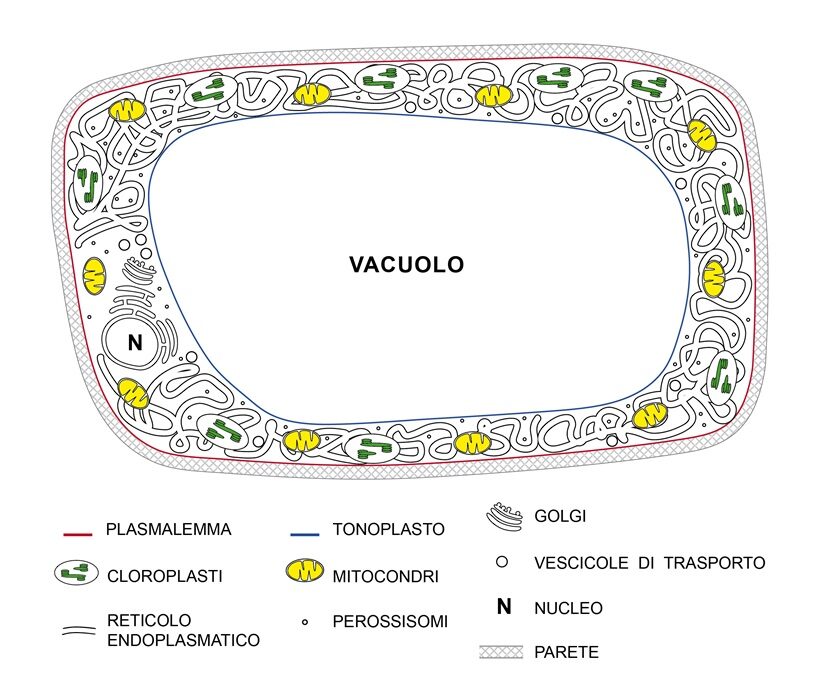
Fig.2– Schematica rappresentazione di una cellula vegetale matura del mesofillo di foglia in pianta vascolare.
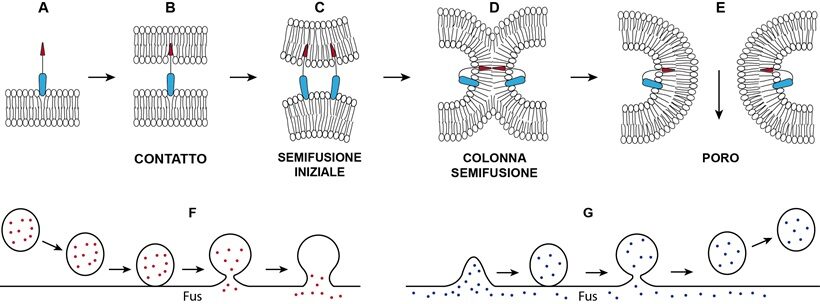
Fig.3-Schema delle tappe di fusione (A, B, C, D, E) di due membrane appaiate con formazione di poro indotta da un fusogeno monomero ipotetico presente in più copie tra le membrane. Il modello didattico fa riferimento al modo di operare unilaterale del fusogeno HAP2, che però agisce come trimero. Analoghe tappe con le SNARE. In semifusione c’è mescolanza delle catene lipidiche interne delle due membrane. Allargamento del poro può aver luogo a seguito di appropriata tensione sulle membrane. F) Fusione (Fus) di una vescicola, in arrivo dal citoplasma, con una membrana (es. tonoplasto) e versamento dei materiali attraverso il poro. G) Gemmazione di una membrana (es. reticolo endoplasmatico, Golgi) generante per fusione (Fus) una vescicola mobile per il trasporto di materiali in vari punti della cellula o in apoplasto. Le tappe F e G hanno luogo durante endocitosi ed esocitosi rispettivamente.
Esocitosi ed endocitosi in risposta immunitaria
Due membrane appaiate espongono internamente le superfici negative generando repulsione elettrostatica (36) (Fig.3). La repulsione tra le due è tanto più forte quante più molecole d’acqua sono spremute via tra le due. In una cellula vegetale matura e turgida il vacuolo esercitando pressione positiva preme il citoplasma in sottile strato sulla parete avvicinando molto il tonoplasto al plasmalemma senza che si abbia tra loro saldatura ovvero fusione; di fatto, nelle cellule vegetali normali fusione tra le due membrane è rigorosamente inibita. Tra così tanti tubuli del reticolo e organuli costipati ci sono punti di contatto dove c’è mescolamento dei lipidi delle due membrane opposte, ma non fusioni (46). In quei punti hanno luogo scambi di lipidi e di calcio e altro per via non vescicolare. Tra plasmalemma, membrane del reticolo e degli organuli saldature sono comunemente inibite per la presenza di proteine “sbatacchio” di vario tipo tali da garantire un distanziamento non inferiore a circa 10 nm (36).
Fusioni di membrane, processo essenziale per lo svolgimento di funzioni vitali nelle cellule degli eucarioti, hanno luogo anche nella risposta immunitaria delle cellule vegetali quando le vescicole di esocitosi ed endocitosi si fondono con la membrana del bersaglio liberando sostanze antimicrobiche: in apoplasto, fondendosi col plasmalemma (esocitosi); nel vacuolo, scaricando prodotti intracellulari di riconoscimento ospite-patogeno, fondendosi col tonoplasto (endocitosi) (Rivista di Agraria N°352) (9,34) (Fig.3).Le fusioni hanno luogo per mezzo di fusogeni, più spesso proteine operanti su entrambe o solo su una membrana delle due per superare le forze repulsive impedenti la loro fusione spontanea, assicurando che la fusione avvenga in modo controllato e regolare (37,50). I fusogeni possono essere ad alto o a basso peso molecolare, prodotti dalla stessa cellula (es. endogeni: in Arabidopsis: SNARE, Fusexina [HAP2 trimero] e RHD3 dimero, proteina periferica di membrana del reticolo endoplasmatico; PSI dimero, della patata) o provenire dall’ambiente (esogeni) (es.EFF1 trimero, effettore). I più noti fusogeni intracellulari sono le proteine SNARE, essenziali per la fusione delle vescicole con la membrana dell’organulo dove scaricano il contenuto (es. in endocitosi); espresse su entrambe le membrane opposte formano fasci a 4 che a guisa di forcina spingono l’una contro l’altra fino ad una distanza di 1nm. A questo punto i foglietti lipidici interni delle due membrane si mescolano dando luogo ad una colonna di semi-fusione. La colonna poi si espande in diametro e si apre al centro un foro che poi si allarga fino a consentire il passaggio dei materiali (20) (Fig.3). Come fusogeno agisce anche da solo lo ione calcio in presenza di particolari lipidi nelle membrane (2). La disposizione di due membrane a fondersi dipende anche da curvatura e tensione cui sono soggette: sono favorevoli curvature negative e tensioni isotropiche (5,20).
Glossario
Omeostasi cellulare: la capacità di una cellula di mantenere ambiente interno stabile adatto a sostenere la vita al variare delle condizioni dell’ambiente esterno a seguito di stress biotici o abiotici.
Non-Self: Una biomolecola o un organismo che la pianta percepisce essere di diversa origine o in condizione differente dal normale, riconosciuti durante la propria attività metabolica per conservare la omeostasi.
DAMP: Molecola proveniente da cellule danneggiate o moribonde (es. eATP, eNAD, amminoacidi, oligogalatturonidi etc.). É riconosciuta dalle cellule normali come “non self”.
Stress: Ogni fattore esterno, o variazione di condizione, capace di allontanare significativamente la pianta dalla sua massima produttività; può agire in senso favorevole o sfavorevole (Matta A. et al., 1986).
Stress biotico: Causato da fattori biologici (es. patogeni)
Stress abiotico: Causato da fattori non biologici, fisici (es. t°) o fisico-chimici (es. pH, molecole organiche).
Biotrofo: un organismo che può vivere e moltiplicarsi solo su un altro organismo vivente.
Emibiotrofo: un organismo che vive solo una parte del suo ciclo (più spesso la prima parte) come biotrofo.
Necrotrofo:un organismo che uccide i tessuti mentre cresce loro attraverso e colonizza il substrato morto.
Apoplasto: Nei tessuti vegetali, tutto ciò che rimane all’esterno della membrana citoplasmatica (o plasmalemma) delle cellule (pareti, spazi intercellulari, trachee, tracheidi).
Simplasto: Nei tessuti vegetali, tutto ciò che rimane all’interno della membrana citoplasmatica: l’insieme dei protoplasti, collegati tra loro dai plasmodesmi, inclusi quelli dei tubi cribrosi del floema.
Citosol: La componente liquida e non strutturata del citoplasma, in cui sono immersi gli organuli (cloroplasti, mitocondri, etc.) e il citoscheletro della cellula vegetale.
Plasmalemma: Sinonimo di membrana citoplasmatica.
Tonoplasto: Denominazione della membrana del vacuolo.
AMP: Adenosina Monofosfato
ATP: Adenosina trifosfato; ADP: Adenosina difosfato;
NAD: Nicotamide adenina dinucleotide; NADH: Forma ridotta del NAD.
ROS: Forme reattive dell’ossigeno: anione superossido, acqua ossigenata, radicale idrossile, etc.
ATP: Adenosina trifosfato; ADP: Adenosina difosfato;
ROS: Forme reattive dell’ossigeno: anione superossido, acqua ossigenata, radicale idrossile, etc.
RBOHD: Acronimo di Respiratory Burst Oxidase Homolog D; Enzima NADPH Ossidasi forma D.
AMPK: Acronimo di AMP-activated protein kinase.
RIPK: Acronimo di Receptor-interacting protein kinase .
ETI: Acronimo di Effector-Triggered Immunity; Seconda fase della risposta immunitaria attivata dagli effettori.
PTI: Acronimo di Pattern-Triggered Immunity; Prima fase della risposta immunitaria attivata da recettori plasmalemma.
NLR: Acronimo di Nucleotide binding domain Leucine-rich repeat Receptor.
CNL: Acronimo di Coiled-coil Nucleotide -Binding site Leucine rich repeat -Tipo di NLR.
TNL: Acronimo di Toll/interleukin-1 receptor/resistance protein -Tipo di NLR.
RNL: Acronimo di Resistance to powdery mildew 8-like domain (RPW8) – Tipo di NLR.
SNARE: Acronimo di Soluble N-ethyl-maleimide-sensitive factor adaptor protein receptors.
Autofagia: Parte di citoplasma della cellula è rinchiusa in una vescicola a doppia membrana e trasferita nel vacuolo dove è digerita da enzimi idrolitici.
Effettore: Tutte le proteine e le piccole molecole (es. tossine) del patogeno che alterano la struttura e funzioni della cellula ospite. Le alterazioni possono facilitare l’infezione (fattori di virulenza) pur sollecitando risposte di difesa della pianta; in certi casi fino a bloccare l’infezione (fattori di avirulenza).
Lavori Citati
1- Agmon E. e B.R. Stockwell, 2017. Current Opinion in Chemical Biology 39,83-89.
2- Allolio C. e D. Harries, 2021. ACS Nano 15,12880-12887.
3- Andrews N.W. e M. Corrotte,2018. Current Biology 28, R367-R420.
4- Bi G. et al., 2021. Cell 184,3528-3541.
5- Churchward M.A. et al.,2008. Biophysical Journal 94,3976-3986.
6- Clucas J. e P. Meier,2023. Nature Reviews Molecular Cell Biology,24,835-852.
7- Codjoe J.M. et al., 2022. The Plant Cell 34,129-145.
8- Cosentino K. et al.,2016. Biochimica et Biophysica Acta 1858,457-466.
9- De la Concepcion J.C.,2023. Current Opinion in Plant Biology76,102482.
10- Flores-Romero H. et al.,2020. The EMBO Journal 39,e105753,1-18.
11- Förderer A. et al.,2022. Current Opinion in Plant Biology 67,102212.
12- Goodman R.N. e A.J. Novacky,1994. The hypersensitive reaction in plants to pathogens. APS Press,244pp.
13- Goodman R.N. et al. 1986. The biochemistry and physiology of plant disease.376-379. Univ. Missouri Press.
14- Gronnier J. et al.,2018. Trends in Plant Science 23,10, 899-917.
15- Hatsugai N. et al.,2009. Genes & Development 23,2496-2506.
16- Hatsugai N. et al.,2018. Plant Physiology 176,1824-1834.
17- Huang S. et al.,2023. Trends in Biochemical Sciences 48,9,776-787.
18- Jia A. et al.,2023. Current Opinion in Plant Biology 73,102334.
19- Kleist T.J. e M.M. Wudick,2022. Current Opinion in Cell Biology 76,102080,1-7.
20- Kozlov M.M. e L.V. Chernomordik,2015. Current Opinion in Structural Biology 33,61-67.
21- Li J. et al., 2021. Botanical Studies 62,5,1-15.
22- Li P. et al., 2021. Molecular Plants 14,1652-1667.
23- Li P. et al.,2020. CRC Critical Review of Plant Science 39,1,72-100.
24- Liu Y. et al.,2005. Cell 121,567-577.
25- Mahlapuu M. et al., 2020. Critical Reviews of Biotechnology 40,7,978-992.
26- Maruta N. et al.,2023. Current Opinion in Plant Biology 73,102364.
27- Mattera R. et al., 2015.The Journal of Biological Chemistry 290,52,30736-30749.
28- Mattera R. et al.,2017. P.N.A.S. 27, E10697-E10706.
29- Minina E.A.et al.,2014. Trends in Plant Science 19,11,692-697.
30- Montesinos E., 2023. Annual Review of Phytopathology 61, 301-324.
31- Nicolson G.L.,2014. Biochemica et Biophysica Acta 1838,1451-1466.
32- Pajerowska-Muktar K. e X. Dong, 2009. Genes & Development 23,2449-2454.
33- Perez-Sancho J. et al.,2016. Trends in Cell Biology 26,9,705-717.
34- Robatsek S.,2007. Cellular Microbiology 9 (1),1-8.
35- Ros U. et al., 2021.Current Opinion in Structural Biology 69,108-116.
36- Scorrano L. et al., 2019. Nature Communications 101287.
37- Segev N. et al., 2018. Current Biology 28, R378-R380.
38- Shimada T. et al., 2018. Annual Review of Plant Biology 69,123-145.
39- Stakman E.C.,1915. Journal of Agricultural Research 4,193-199.
40-Tavormina P. et al., 2015. The Plant Cell 27,2095-2118.
41- Thompson W.W. et al.,1969. P.N.A.S.,63,310-317.
42-Üstün S. et al., 2017. Current Opinion in Plant Biology 40,122-130.
43- Van Doorn W.G. et al., 2011. Cell Death and Differentiation 18,1241-1246.
44- Vassiliev A.E. e A.A. Stepanova,1990. Journal of Experimental Botany 41,222,41-46.
45- Wang C. e S. Luan, 2024.Current Opinion Plant Biology 77,102485,1-10.
46- Wang J-Z. e K. Denesh, 2018. Current Opinion in Plant Biology 45,171-177.
47- Wang Z. et al., 2023. P. N. A. S. 120,32, e 222203610,1-11.
48-Wu B. et al., 2022. Molecular Plants 15,5, 887-903.
49- Wu B. et al., 2023.Trends in Plant Science 28,10,1124-1131.
50- Yang Y. e N.N. Margam, 2021.Cells 10,160,10010160,1-17. MDPI.
51- Zhang T. et al., 2023. Science 380,1372-1380.
52- Zheng H., 2021. Journal of Plant Physiology 266,153540,1-2.
Umberto Mazzucchi è stato professore ordinario di Patologia Vegetale alla Università degli Studi di Bologna dal 1989 al 2010. Docente del corso di Patologia Vegetale e di alcuni corsi specialistici di materie fitopatologiche, ha svolto ricerche sulle interazioni ospite-patogeno nel processo infettivo e sulla risposta immunitaria delle piante.
Pensionato dal 2010, come professore dell’Alma Mater ha svolto seminari occasionali e cicli di lezioni in corsi ufficiali della Università di Bologna.