di Umberto Mazzucchi
Essudato di Ralstonia solanacearum da taglio di patata infetta
Prima Parte
- Il segnale induttore
- La necrosi ipersensitiva come sorgente di segnali
- Il calcio segnale ubiquitario per la risposta delle piante agli stress
Seconda Parte
- Un modello di segnalazione per l’induzione della SAR
- Accettabilità del modello
Lavori citati
Glossario
Il segnale induttore
In appunti precedenti (Rivista di Agraria N°362,364) è stata descritta la risposta immunitaria delle piante facendo per lo più riferimento ad infezioni localizzate di agenti patogeni. Si è visto che nelle cellule della areola di tessuto coinvolto a contrastare la colonizzazione microbica abbia luogo nell’arco di poche ore una risposta immunitaria ben articolata nelle due fasi sinergiche PTI ed ETI. Da almeno 40 anni (14) si sa che la infezione localizzata di un patogeno su un organo di una pianta (es. maculatura fogliare) (infezione d’innesco) può indurre a distanza in tessuti di quella pianta (organo indotto) per parecchi giorni uno stato sensibilizzato contraddistinto da una risposta immunitaria di difesa più efficace, aspecifica, nei confronti di eventuali tentativi di infezione sia da parte dello stesso agente della infezione d’innesco, sia di altri agenti patogeni solo se biotrofici o emibiotrofici (batteri, oomiceti, funghi e virus), ma non necrotrofici (Fig.1, A).
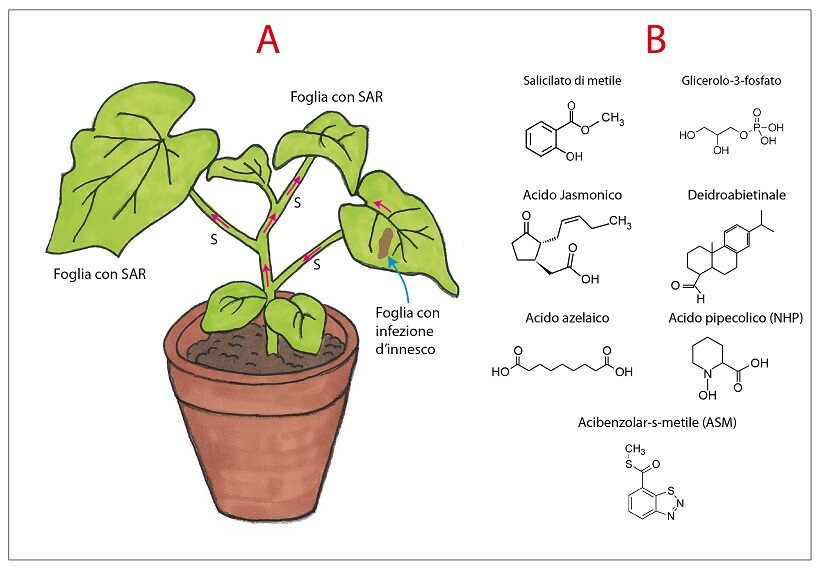
Fig.1 – Riflessioni sulla risposta immunitaria sistemica delle piante
A – Pianta di cetriolo con foglia basale affetta da maculatura necrotica causata da reazione ipersensibile a seguito di infiltrazione intercellulare di sospensione di un batterio fitopatogeno incompatibile fatta 6 giorni prima. Nelle foglie superiori è stata indotta la SAR caratterizzata da una risposta immunitaria più pronta ed efficace. Le foglie della pianta sono protette da infezioni di patogeni biotrofici e emibiotrofici, ma non necrotrofici. Le frecce rosse indicano l’ipotetico percorso del segnale induttore della SAR generato nella foglia basale con la maculatura.
B – Formule chimiche delle molecole naturali trovate associate alla SAR. Applicate alle piante inducono uno stato di protezione assimilabile alla SAR (a destra). ASM è di sintesi.
L’effetto si ha anche quando l’infezione d’innesco è stata abortiva ovvero l’inoculazione del patogeno ha avuto inizio, ma non successo, a seguito della morte ipersensibile (HR) delle cellule dell’ospite coinvolte. Inoculazioni d’innesco ripetute potenziano la risposta a distanza. Il tempo di comparsa della risposta a distanza è associato allo sviluppo della necrosi d’innesco. In cetriolo, ad esempio, con inoculazione di batterio causante HR nella prima foglia, si è valutato almeno 6 ore il tempo necessario per rilevare lo stato indotto nella seconda foglia, quando nella area inoculata si cominciano a notare i sintomi iniziali di collasso, ma la necrosi ipersensitiva non è ancora visibile (8).
Nei tessuti a distanza sensibilizzati, dove sono espressi geni di proteine di patogenesi, di perossidasi, di proteine ricche di idrossiprolina e soprattutto c’è accumulo di acido salicilico (8), la risposta immunitaria ad infezioni provocatrici diviene più pronta (es. stress ossidativo, modificazioni di parete, sintesi di fitoalessine, etc.). Lo stato indotto dura parecchi giorni, è trasmissibile per innesto e per propagazione vegetativa (14).
La induzione a distanza di uno stato immunitario più pronto alla risposta è stata denominata resistenza sistemica acquisita, nota comunemente come SAR, acronimo delle parole inglesi Systemic Acquired Resistance. Non considerando i contributi di pionieri sulla immunizzazione delle piante (3), le ricerche di base sulla SAR hanno avuto luogo per lo più nel ventennio 1980-2000 e i modelli sperimentali hanno riguardato dapprima cetriolo, fagiolo e tabacco, recentemente Arabidopsis thaliana per gli studi molecolari. Virus, batteri e funghi possono attivare la SAR che offre protezione verso una vasta gamma di patogeni.
Fin dagli inizi ebbe consenso l’ipotesi che la SAR fosse causata da un segnale proveniente dalla foglia avente l’infezione d’innesco già dopo 6 ore dalla inoculazione e trasmesso ad organi distali, per lo più via acropeta per mezzo dei tessuti conduttori, xilema e floema, senza escludere che per propria volatilità il segnale potesse operare anche per via aerea.
Le ricerche dell’ultimo ventennio non sono ancora riuscite ad individuare con certezza un unico segnale chimico traslocabile nella pianta che autonomamente sia responsabile della induzione della SAR (10). Associate alla SAR sono stati individuate almeno 6 molecole: metilsalicilato, acido 3-fosfoglicerico, acido azelaico, deidroabietinale, acido giasmonico e acido N-pipecolico (NHP) (Fig.1, B). Tra queste candidate naturali, NHP è la più accreditata (21,34); di fatto si sa che dall’ amminoacido lisina attraverso quattro tappe metaboliche [deaminazione, ALD1→ciclizzazione e riduzione, SARD4→idrossilazione, FMO1→NHP] si produce NHP traslocabile a distanza via floema nella pianta. Applicazioni delle sei molecole in parola su organi vegetali e anche di NADPH (ovvero eNAD, un DAMP) sono in grado di indurre uno stato di protezione riferibile a quello della SAR. In realtà questo tipo di trattamento come quelli con sostanze induttrici di sintesi o di origine microbica (es. DCINA, ASM, TDL, Harpin etc.; (8) costituisce stress abiotico per i tessuti della pianta e quindi evoca risposta nelle cellule (30,35). Di fatto ad ogni stress, biotico o abiotico, la pianta risponde da secondi a minuti dalla sua percezione e la risposta comporta cambiamenti del metabolismo e trascrizioni del genoma che coinvolgono anche attori della risposta immunitaria. In realtà questo fantomatico segnale chimico per la SAR dovrebbe fuoriuscire in tempi appropriati dalle tracce fogliari sul fusto recidendo il picciolo della foglia su cui c’è induzione di resistenza oppure da quelle alla base del picciolo della foglia dove c’è l’infezione d’innesco; in altre parole, il segnale dovrebbe già essere in traslocazione dopo 2-6 ore dalla inoculazione d’innesco (1,22,28); d’altra parte dovrebbe fungere da mero segnale senza necessariamente accumularsi nei tessuti dell’organo indotto.
Da alcune brillanti ricerche degli ultimi anni è maturata opinione che da una ferita su un organo della pianta (es. una foglia basale di Arabidopsis ) si generi un segnale composito, innescato da DAMP, costituito da onde ossidative, elettriche e di Ca2+concatenate, che trasloca all’interno della pianta da citoplasma a citoplasma e lungo i plasmalemmi coinvolgendo i tubi cribrosi del floema fino ad arrivare agli organi distali dove attiva risposte fisiologiche; contemporanea ai tre tipi di onde precedenti s’associa un’onda idraulica causata dalla blanda cavitazione dei vasi di xilema recisi dalla ferita (2,4,6,9,19,27). Nelle piante le onde intracellulari di ROS e di calcio e quelle elettriche traslocate via plasmalemmi sono ritenute segnali basilari per la segnalazione degli stress abiotici al fine di indurre negli organi appropriate risposte di acclimatazione (SAA ; Systemic Acquired Acclimation) (19,35). Le attuali conoscenze suggeriscono che anche per la induzione a distanza della SAR la segnalazione potrebbe aver luogo analogamente a quanto descritto per gli stress abiotici, ferite in primo luogo.
La necrosi ipersensitiva come sorgente di segnali
Si è visto come l’infezione d’innesco per indurre la SAR possa essere abortiva dando luogo a necrosi cellulari da reazione di ipersensibilità (HR) (vedi Rivista di Agraria N°351). A seguito di inoculazioni sperimentali sulle foglie, l’esito è comunemente costituito da aree circoscritte di tessuti necrotici (particolarmente di mesofillo e palizzata), ben visibili entro il lembo (Fig.1, A); in condizioni naturali singole cellule o piccoli gruppi di cellule ipersensibili morte sono invisibili ad occhio nudo. Nelle cellule vegetali ipersensibili hanno luogo: perdita di elettroliti dalle membrane cellulari, persistente produzione di flussi di Ca2+, di ROS, NO e SA; produzione di ROS si ha non solo a livello di plasmalemma con accumulo di acqua ossigenata in parete, ma anche da cloroplasti e mitocondri; attivazione di enzimi proteolitici cisteina-endopeptidasi, inclusi i VPE (Vacuolar Processing Enzymes), cui segue rottura del tonoplasto e collasso del vacuolo. Nelle cellule vive non ipersensibili del lembo fogliare, tutt’attorno a quelle ipersensibili, si attiva autofagia, reazione di difesa per delimitare l’area necrotica ipersensitiva, impedendo che si allarghi a dismisura sul lembo (7,17,20). Evidentemente dalle cellule ipersensibili devono essere traslocati segnali di vario tipo alle cellule vive limitrofe; d’altra parte s’è visto che all’avvio della HR, dopo 4-6 ore dall’inizio di interazione incompatibile, c’è attivazione delle NADPH ossidasi con produzione di ROS (1, 22). Questi dati indicano che le cellule ipersensibili siano sorgenti di ROS (H2O2 in particolare) e di DAMP, tra cui verosimilmente amminoacidi. Anche in caso di necrosi cellulari normosensitive, causate da patogeno omologo virulento, durante o al termine del periodo di incubazione, è verosimile che nella zona infetta siano prodotti ROS e liberati DAMP, tenendo conto che in tal caso possono svolgere un ruolo anche effettori del patogeno attivi in apoplasto e simplasto. Basti pensare che sono noti effettori inibenti l’attività della RBOHD, enzima chiave per l’avvio della risposta PTI (vedi Rivista di Agraria N°362, Fig.1) e, come vedremo, per la trasmissione del segnale per la SAR.
Queste conoscenze suggeriscono che anche per la induzione della SAR sia possibile proporre il modello di segnalazione sistemica descritto di seguito, accettato correntemente per la induzione di stati acclimatati negli organi della pianta a seguito di stress abiotici, in particolare di ferite (27,35).
Il calcio segnale ubiquitario per la risposta delle piante agli stress
Per la loro immobilità la vita delle piante in un dato ambiente dipende dalla loro capacità di adattamento agli stress biotici e abiotici locali. Nelle cellule vegetali, in assenza di qualsiasi stimolo, la concentrazione dello ione calcio Ca2+nel citosol è tenuta molto bassa [circa 10-7M; 50-100 nM ] in modo che una minima sua variazione possa fungere da segnale (11). Di fatto, qualsiasi stress su organo di una pianta genera un segnale di allarme nelle cellule dei tessuti coinvolti, costituito comunemente da un incremento di concentrazione di calcio nel citosol, assai inferiore in assenza di stress a quella dell’apoplasto [10-3M; 330 µM-1mM ] e del vacuolo [0,2-5mM] (25) e degli altri comparti intracellulari (reticolo endoplasmatico, mitocondri, cloroplasti, Golgi, perossisomi ). L’incremento ha luogo per attivazione di canalicoli associati alle membrane loro contornanti o patologici come si è visto per la risposta immunitaria locale (resistosomi) (Rivista di Agraria 364). Per la risposta agli stress (e verosimilmente anche per la SAR) in particolare è opinione corrente che abbiano ruolo determinante canalicoli condizionanti il passaggio dello ione calcio (Ca2+) da un comparto cellulare all’altro, in particolare dall’apoplasto e dal vacuolo al citosol (13). Poche informazioni propedeutiche ne rendono più comprensibile la funzionalità.
Un canalicolo non è che un pertugio idrofilo di diametro molecolare (es. 7 nm in TCP1, nel punto più stretto) che si apre o si chiude all’interno di proteine integrali a subunità aggregate nelle membrane dei vari comparti della cellula (es. tonoplasto del vacuolo; plasmalemma del citoplasma etc.) (Fig.2 C e D). Comunemente apertura e chiusura hanno luogo a seguito di modificazioni di conformazione, controllate e reversibili, di subunità componenti, causate dal potenziale (vedi oltre) o da loro legame con ione o molecola. É un rapporto assimilabile a “chiave-serratura”, più o meno specifico secondo i casi, dove valore del potenziale o lo ione o la molecola fungono da “chiave”. Si sa comunque che l’apertura di certi canalicoli può aver luogo anche per locali deformazioni della membrana in cui si trovano a seguito di fattori meccanici (es. sfregando con un dito zona di una foglia!). L’apertura consente il passaggio di ioni o molecole tra una faccia e l’altra e, nei casi di membrana contornante comparto cellulare, entrata o fuoriuscita dal quel comparto. A seguito del passaggio selettivo di ioni in membrana tra due comparti, la loro concentrazione viene a divergere tra i due in modo che tra una faccia e l’altra della membrana si crea una differenza di potenziale elettrico misurabile in Volt (es. voltaggio tonoplasto del vacuolo a riposo -30 mV). Per potenziale di membrana di una cellula si fa riferimento al plasmalemma separante citoplasma da apoplasto. Una cellula avente un dato potenziale in equilibrio si dice polarizzata. Se ad un certo momento in un plasmalemma in equilibrio il passaggio di uno ione con una data carica prevale, il potenziale si altera e inizia depolarizzazione e, se la variazione supera una soglia critica, si ha un picco (Fig.2 A) da cui inizia la ripolarizzazione. Il picco si trasmette passivamente al vicino tratto di membrana non eccitata e oltre lungo il suo percorso, generando un segnale elettrico. La ripolarizzazione ha luogo con adeguato attraversamento direzionato di ioni aventi carica tale da ricostituire l’equilibrio tra le due facce del plasmalemma (Fig.2 A e B). I valori di potenziale di membrana polarizzata, depolarizzata e ripolarizzata si misurano con elettrodi inseriti in punti appropriati. Diversi metodi consentono di misurare i segnali elettrici delle piante, conseguenza di movimenti di ioni attraverso membrane (16).
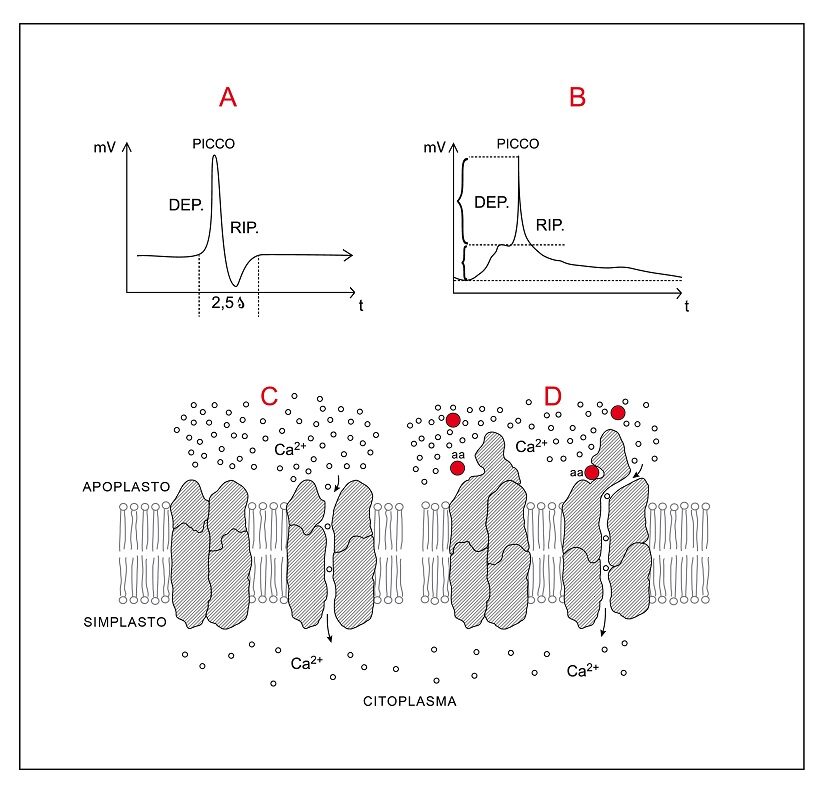
Fig. 2 – Riflessioni sulla risposta immunitaria sistemica delle piante
A – Grafico mostrante il ciclo teorico depolarizzazione-ripolarizzazione di una cellula vegetale con produzione di un picco di potenziale di membrana generante un potenziale di azione ( Action Potential ; AP). La durata del ciclo è indicata a 2,5 secondi.
B – Riproduzione di un grafico reale di depolarizzazione cellulare in foglia di A. thaliana a seguito di ferita su un’altra foglia.
C – Una proteina integrale a 4 subunità aggregate è associata al plasmalemma. In particolari condizioni la conformazione delle subunità si altera in certe zone generando uno stretto canalicolo centrale di diametro tale da lasciar passare gli ioni calcio. Il canalicolo si crea all’interno della massa proteica. La figura mostrerebbe una sezione verticale. Il passaggio del calcio da apoplasto o da un organulo citoplasmatico a citosol è favorito dal gradiente di concentrazione.
D – In una proteina integrale a subunità aggregate la parte esposta in apoplasto offre un sito di legame per un particolare amminoacido (aa). Quando quell’amminoacido si lega al sito, la conformazione delle subunità si altera dando luogo internamente ad un canalicolo favorevole al passaggio del calcio da apoplasto a citoplasma. La proteina viene a svolgere duplice ruolo: di recettore per un amminoacido e di canalicolo per il calcio (es. GLR3).
Nella risposta immunitaria (Rivista di Agraria 362, Fig.1) si è visto come i canalicoli CNGC4/CNGC2 del plasmalemma si aprono a seguito di fosforilazione della chinasi BIK1 e causano flusso di Ca2+ dall’apoplasto al citoplasma per gradiente assai favorevole (cioè da 10-3M a 10-7M ). I più importanti canalicoli a ruolo immunitario associati al plasmalemma che dall’apoplasto immettono calcio nel citoplasma si ritiene siano: OSCA1.3/1.7; GLR7/8/9/6/3; CNGC 2/4, 20/19,11/12 (11).
I canalicoli GLR (dall’acronimo di Glutamate Receptor-like channels), ubiquitari nelle piante, fungono anche da recettori per amminoacidi, principalmente per glutammato (L-acido glutammico; L-glu) e glicina. In A. thaliana sono noti 20 geni. I GLR associati al plasmalemma sono assimilabili a recettori immunitari: esposti in apoplasto, si ammette percepiscano la presenza di amminoacidi liberati da cellule limitrofe aggredite da stress biotici (es. batteri, funghi) o abiotici (es. ferite), riferibili a DAMPs (Damage-Associated Molecular Patterns ) (5) (Fig.2, D ). In A. thaliana i GLR3 associati al plasmalemma sono assai coinvolti nella trasmissione a distanza del segnale immunitario: legandosi a glutammato si aprono e causano un abbondante passaggio di ioni Ca2+dall’apoplasto al citoplasma.
Lavori citati
1) Alvarez M.E. et al. ,1998. Cell 92,773-784.
2) Castro B. et al., 2021. Nature Plants 7,403-412.
3) Chester K.S. 1933. The Quarterly Review of Biology 8,129-154.
4) Fichman Y. et al. ,2019. Molecular Plants 12,1203-1210.
5) Forde B. e M.R. Roberts,2014. F1000Prime Reports 6 :37.
6) Gilroy S. et al.,2016. Plant Physiology 171,1606-1615.
7) Goodman R.N. e A.J. Novacky,1994. The hypersensitive reaction in plants to pathogens. 244pp. APS Press.
8) Hammerschmidt R.,2009. Systemic acquired resistance. In Advances in Botanical Research. Vol.51,174-222.
9) Johns S. et al. ,2021. Plant Physiology 185,694-706.
10) Kachroo A. e P. Kachroo, 2020.Current Opinion in Plant Biology 58,41-47.
11) Kim N.H. et al., 2022. New Phytologist 234,813-818.
12) Kong X. et al., 2020. Trends in Plant Science 25,9,838-841.
13) Köster P. et al.,2022. The EMBO Journal 41, e110741.
14) Kuc’ J.,1987. Annals New York Academy of Sciences,494,221-223.
15) Lee DH. et al., 2020.Nature Communications 11, 1838, 1-16.
16) Li J-H. et al.,2021. Journal of Plant Physiology 261,153418.
17) Liu Y.et al. ,2005. Cell 121,4,567-577.
18) Martin R.E. et al., 2022. Current Opinion in Plant Biology 69,102293.
19) Mittler R. et al. ,2022. Nature Reviews Molecular Cell Biology 23,663-679.
20) Mur L.A.J. et al., 2008. Journal of Experimental Botany 599,3,501-520.
21) Moorman J. et al.,2022. Trends in Biochemical Sciences 47,10,839-850.
22) Morales J. et al.,2016 Journal of Experimental Botany 67,1663-1676.
23) Noctor G. et al.,2018. Seminars in Cell & Development Biology 80,3-12.
24) Osler R.,2021. Le piante immunizzate. Ed.Forum, 183pp.
25) Pirayesh N. et al. ,2021. BBA Molecular Cell Research 1868,118948.
26) Robinson D.G. e A. Draguhn,2021. Journal of Plant Physiology 263, Art.15347.
27) Toyota M. et al., 2018. Science 361,1112-1115.
28) Truman W. et al.,2007. PNAS 104,3,1075-1080
29) Vlot A.C. et al., 2021.New Phytologist 229,1234-1250.
30) Volkov A.G. e D.R.A. Ranatunga2006. Plant Signals Behaviour 1, 3, 105-115.
31) Wang C. et al.,2019. Nature Communications 10,4810.
32) Wang R.et al., 2020.Trends in Plant Science 25,11,1060-1062.
33) Wu F.H. et al., 2020.Nature 578,577-581.
34) Zeier J.,2021. Current Opinion in Plant Biology 62, 102050.
35) Zhang H. et al.,2022. Nature Reviews Genetics 23,1104-1119.
36) Zimmerman C. et al.,2009. Plant Physiology 149,1593-1600.
Glossario
Non-Self: Una biomolecola o un organismo che la pianta percepisce essere di diversa origine o in condizione differente dal normale, riconosciuti durante la propria attività metabolica per conservare la omeostasi.
DAMP: Molecola proveniente da cellule danneggiate o moribonde (es. eATP, eNAD, amminoacidi, oligogalatturonidi etc.). É riconosciuta dalle cellule normali come “non self”.
Sistema immunitario innato: Capacità di percepire come segnale di pericolo il non sé (non-self) e il sé danneggiato o alterato (DAMP) e di rispondere, usufruendo di appropriati strumenti di sorveglianza.
Stress: Ogni fattore esterno, o variazione di condizione, capace di allontanare significativamente la pianta dalla sua massima produttività; può agire in senso favorevole o sfavorevole (Matta A. et al., 1986)
Stress biotico: Causato da fattori biologici (es. patogeni)
Stress abiotico: Causato da fattori non biologici, fisici (es. t°) o fisico-chimici (es. pH, molecole organiche)
Apoplasto: Nei tessuti vegetali, tutto ciò che rimane all’esterno della membrana citoplasmatica (o plasmalemma) delle cellule (pareti, spazi intercellulari, trachee, tracheidi).
Simplasto: Nei tessuti vegetali, tutto ciò che rimane all’interno della membrana citoplasmatica: l’insieme dei protoplasti, collegati tra loro dai plasmodesmi, inclusi quelli dei tubi cribrosi del floema.
Citosol: La componente liquida e non strutturata del citoplasma, in cui sono immersi gli organuli (cloroplasti, mitocondri, etc.) e il citoscheletro della cellula vegetale.
Plasmalemma: Sinonimo di membrana citoplasmatica. Nel testo per la struttura si fa riferimento alla teoria del mosaico fluido rivisitata (Nicolson G.L,2014; Gronnier et al.,2018).
Recettore : Struttura capace di reagire a stimoli dando luogo ad una reazione caratteristica.
Trasduzione : Una molecola segnale esterna attiva uno specifico recettore dentro o alla superficie della cellula. Questo recettore va ad attivare una via biochimica dentro la cellula, creando una risposta.
ROS : Forme reattive dell’ossigeno: anione superossido, acqua ossigenata, radicale idrossile, etc.( 19 )
ATP : Adenosina trifosfato; ADP: Adenosina difosfato;
NAD : Nicotamide adenina dinucleotide;
NO : Ossido di azoto;
HR : Reazione di ipersensibilità. Per una cellula comporta morte;
Ubiquitina : Piccola proteina che si lega singola o a catenella alle proteine “difettose” o “usurate” da distruggere. Le proteine marcate ovvero “ubiquitinate” sono avviate al proteasoma per essere distrutte;
Proteasoma : All’interno delle cellule, struttura cilindrica tubolare costituita da proteine che espongono nella cavità interna siti catalitici per la distruzione delle proteine. Le proteine marcate con ubiquitina entrano all’imbocco del “tubo” e percorrendo la cavità interna vengono via via degradate per rottura dei legami tra gli amminoacidi. Alla uscita, brevi catene di amminoacidi sono a disposizione della cellula;
Aquaporina: Piccola proteina a 6 eliche transmembrana con estremità C e N esposte al citosol, con poro centrale idrofilo; associate a tetrameri in plasmalemma, reticolo endoplasmatico e tonoplasto permettono passaggio di acqua e di altre sostanze tra cui H2O2;
RBOH: Acronimo di Respiratory Burst Oxydase Homolog; RBOHD e RBOHF sono due forme di RBOH.
Enzima NADPH Ossidasi (NOX);
SA : Acido salicilico.
Umberto Mazzucchi è stato professore ordinario di Patologia Vegetale alla Università degli Studi di Bologna dal 1989 al 2010. Docente del corso di Patologia Vegetale e di alcuni corsi specialistici di materie fitopatologiche, ha svolto ricerche sulle interazioni ospite-patogeno nel processo infettivo e sulla risposta immunitaria delle piante. Pensionato dal 2010, come professore dell’Alma Mater ha svolto seminari occasionali e cicli di lezioni in corsi ufficiali della Università di Bologna.







