Seconda parte – Forme ed espressioni della memoria immunitaria
di Umberto Mazzucchi

Maculature di Pseudomonas syringae pv. actinidiae su foglia di kiwi
Forme ed espressioni della memoria immunitaria
Memoria immunitaria è espressa da una pianta verso un dato patogeno quando le cellule della pianta riescono a mettere in atto nei confronti di quel patogeno barriere di difesa assai più efficaci rispetto a quelle espresse verso lo stesso patogeno nel corso delle interazioni precedenti, tali da prevenire o ridurre gli esiti delle sue nuove infezioni (4, 9, 13, 27,29).La memoria immunitaria sarebbe specie-specifica se si attivasse con strumenti specifici nei confronti dei membri della specie cui appartiene il patogeno induttore.
Per le malattie infettive delle piante (da virus, procarioti ed eucarioti) le interazioni ospite-patogeno evocano sempre nella pianta ospite regolazione epigenetica della risposta di difesa coinvolgente metilazione/de-metilazione del DNA ,modifiche di istoni e variazioni trascrizionali, traduzionali e post-traduzionali (30,31).Il risultato della regolazione quando si conserva nel tempo genera memoria; in altre parole, le modifiche apportate nella cromatina delle cellule persistono e costituiscono memoria; quelle riguardanti la messa in atto del supplemento di misure difensive a seguito dello stress biotico attivante esprimono memoria immunitaria (18,22). La memoria nelle cellule può conservarsi per vario tempo in rapporto alla capacità di superare o meno la meiosi: durare solo per una generazione, ma non passare alla generazione successiva (memoria somatica); passare a generazioni successive con solo una generazione senza stress (memoria intergenerazionale) o con almeno due generazioni senza stress (memoria transgenerazionale) (14). La memoria somatica passa la mitosi e si trasmette con propagazione vegetativa (Fig.2). In piante erbacee la memoria per la siccità è per lo più somatica.
La memoria immunitaria coinvolge espressione di geni connessi a barriere fisiche, cicli di metaboliti secondari coinvolti nella difesa (11), ma anche caratteri riguardanti crescita e metabolismo energetico della pianta, correlati negativamente o positivamente al processo infettivo in atto.
Ai fini di una difesa più efficace al superamento dello stress biotico, le variazioni della risposta conseguenti alle modificazioni della cromatina potenziano naturalmente le risposte immunitarie innate, tra loro integrate, di PTI e ETI dove, com’è noto, hanno luogo interazioni molecolari specifiche tra recettori della pianta ospite e molecole del patogeno, particolarmente in fase ETI tra effettori dei patogeni e proteine NLR della pianta (20). Nelle risposte potenziate a seguito di memoria immunitaria non c’è evidenza che abbiano luogo riconoscimenti molecolari supplementari, analoghi a quelli aventi luogo in PTI e ETI o mirati alla identità biologica del patogeno-stress che indusse la memoria nella pianta. Così, ad esempio, piante di Arabidopsis thaliana dotate di memoria immunitaria indotta dallo stress batterico Pseudomonas syringae pv. tomato mostrano efficace resistenza sia verso lo stesso batterio generatore della memoria, sia verso l’oomicete Hyaloperonospora arabidopsidis, entrambi, però, patogeni emibiotrofici (17), appartenenti a due classi tassonomiche distinte e con differenti strumenti di aggressione. É noto che i patogeni si distinguono in biotrofici, emibiotrofici e necrotrofici. Verosimilmente la strategia di difesa via regolazione epigenetica messa in atto dalla pianta può avere più successo con biotrofici e emibiotrofici ed essere problematica con necrotrofici (3,15). Non si trova attualmente evidenza sperimentale di specie-specificità delle barriere di difesa espresse da una pianta attraverso memoria immunitaria.
Ogni pianta vascolare asintomatica, erbacea o arborea, alberga in tutti i suoi organi epi- ed ipogei microrganismi endofiti ed epifiti costituenti il proprio microbiota, (2,8,25,26). [analogamente a quanto ha luogo nel corpo umano (10)], miriade di microbi appartenenti anche a distinte classi tassonomiche, commensali, simbionti e talora potenzialmente patogeni, viventi in equilibrio omeostatico con la pianta ospite. Il microbiota con la propria attività conferisce protezione alla pianta verso i patogeni prima, durante [richiamati in aiuto (!) dalla pianta] e dopo il loro processo infettivo, permanendo a disposizione nell’ambiente (21). L’accorpamento del microbiota è un processo a tappe che ha luogo lungo tutta la vita della pianta a partire dalla eredità microbica ricevuta direttamente dai genitori via seme o via propagazione vegetativa da piante madri (28). Superamento di uno stress biotico “positivo” fu per la pianta la integrazione di ogni microrganismo non-self in una propria nicchia endofita o epifita, dopo un processo di riconoscimento in negativo favorevole (19,24), svolto per lo più nella fase difensiva PTI (20,22). Per ogni nuovo “arruolamento” selezionato per il proprio microbiota attraverso una variazione epigenetica di cromatina, come per ogni stress biotico, c’è stata verosimilmente acquisizione di strumenti molecolari per memoria immunitaria, ovvero “ritocchi” nella regolazione epigenetica della espressione genica già in atto. Ogni pianta sana con proprio microbiota in equilibrio (olobionte) ha pertanto condizionato la reattività del proprio sistema immunitario a seguito di adattamento alla miriade di stress biotici connessi alla formazione del microbiota; di conseguenza ha acquisito capacità di esprimere resistenza sistemica con barriere fisiche e chimiche aspecifiche ai patogeni che incontra (Induced Systemic Resistance) (ISR) (6,7,8). La reattività immunitaria di una pianta sana con microbiota in equilibrio indica che la ISR sia conseguenza di memoria immunitaria (Fig. 2). La ISR differisce dalla Systemic Acquired Resistance (SAR): non è associata ad accumulo di proteine di patogenesi o di acido salicilico e coinvolge etilene e acido giasmonico. La ISR con barriere fisiche e chimiche predispone la pianta ad affrontare efficacemente i patogeni. Fino circa al 2013, erano evasivi i meccanismi molecolari coinvolti nella induzione di resistenza a seguito di stress biotici e abiotici (7).
L’equilibrio immunitario pianta ospite-microbiota esprime autoimmunità. Turbando la composizione del microbiota, l’equilibrio autoimmune della pianta si altera con danni a tessuti di organi (5,16,24). Rischi di disbiosi causate da alterazioni di microbiota, note nell’uomo, sono pertanto possibili anche nelle piante (1,10,24), probabilmente con maggior frequenza di quanto pensiamo. Il sistema autoimmune di una pianta, monitorata per trascrizioni di geni coinvolti in risposte di difesa, è tale da avviarsi al momento della reidratazione dopo un periodo di moderata siccità ed esprimere poi resistenza nei confronti di patogeni (12). L’attivazione nei minuti successivi alla reidratazione è stata interpretata profilattica, prevedendo incremento di attività microbica (patogeni e microbiota inclusi) nelle loro nicchie epifite o endofite per maggiore umidità dell’aria dopo l’idratazione. Durante la stagione vegetativa nelle piante agrarie erbacee questo avvio profilattico della difesa potrebbe aver luogo di notte con umidità atmosferica più elevata rispetto al pomeriggio e durante bagnature della vegetazione.
Anche i patogeni procarioti e eucarioti possono applicare regolazione epigenetica della espressione genica nel corso della interazione con la pianta ospite e crearsi memoria (31). Tutte e tre le forme di memoria immune delle piante, particolarmente quelle durevoli, possono generare pressione selettiva sulle popolazioni del patogeno e dar luogo per via genetica e/o epigenetica alla comparsa di popolazioni di appropriata virulenza per il successo delle infezioni. Anche applicando strumenti epigenetici nel miglioramento delle piante agrarie per la lotta alle malattie infettive permangono purtroppo rischi di insuccessi condizionati dalla eterna lotta tra aggressore e pianta ospite. Di fatto è possibile che a seguito di pressione selettiva un patogeno produca effettori tali da compromettere anche il successo della regolazione epigenetica quando la strategia fosse comune e di frequente uso da parte della pianta ospite.
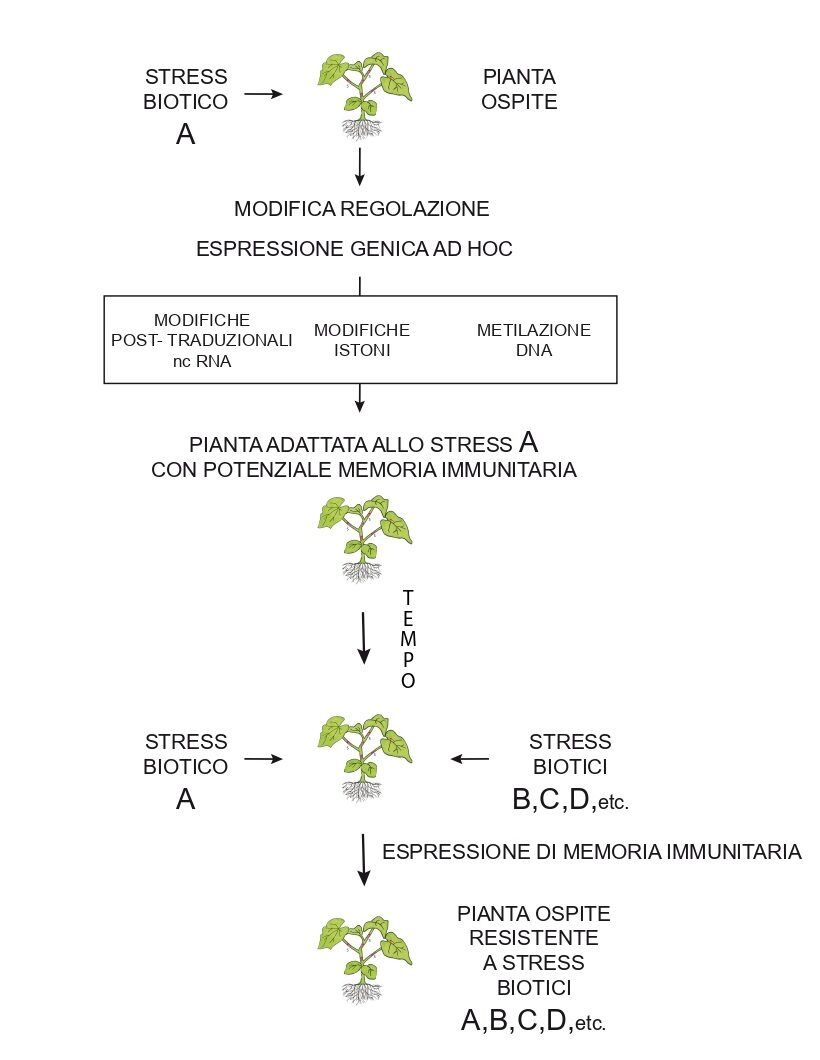
Fig.2. Formazione ed espressione della memoria immunitaria in una pianta erbacea annuale. Soggetta allo stress biotico A la pianta reagisce e modifica la regolazione della espressione dei propri geni agendo su DNA (con metilazioni, Met, Met Fig.1), su uno o più istoni (con acilazioni, Acil Fig.1) e sui processi di trascrizione e traduzione delle proteine via RNA non codificanti. Applicando le modifiche, la pianta si è adattata alla situazione creata dallo stress A e possiede ora nel genoma impronte epigenetiche che le conferiscono potenzialmente la capacità di esprimere poi memoria immunitaria. Dopo qualche tempo, incontrandosi con uno o più stress biotici A, B, C, D, etc. la pianta può esprimere più facilmente cambiamenti del fenotipo tali da adattarsi meglio e/o più rapidamente alle nuove situazioni. Esempio: esprimere maggiore resistenza alle infezioni di patogeni con barriere fisiche e chimiche e dosare adeguatamente il proprio metabolismo ai processi infettivi in atto.
Lo stress biotico A può essere un microrganismo simbionte o commensale (futuro membro microbiota della pianta) o un patogeno causa di infezione e morte di cellule vegetali (es. maculature brune circoscritte con alone clorotico su foglia; figura iniziale parte 2)). Per le cellule vegetali l’uno e l’altro sono non-self. In entrambi i casi si avvia riconoscimento con MTI e si genera memoria immunitaria che si esprimerà poi come induzione di resistenza, che si può interpretare come ISR e SAR rispettivamente. Ambiguità per gli effetti dei due tipi di interazione deriva dal fatto che morti di una o poche cellule vegetali sono asintomatiche.; solo gruppi di almeno 50 cellule morte si rendono visibili ad occhio nudo su foglie come minuscoli punti bruni.
Lavori citati (Seconda parte)
1- Arnault G. et al.,2023. Trends in Plant Science 28,1,18-30.
2- Arnold W. et al.,2025. Nature 644,1039-1048.
3- Bi K. et al.,2022. Trends in Plant Science 28,2,211-222.
4- Boyko A. e I. Kovalchuk,2011. Molecular Plants 4,6,1014-1023.
5- Cheng Y.T. et al.,2024. Nature Plants 10,1363-1370; 1291-1292.
6- Conrath U.,2009. In: Van Loon L.C., Plant innate immunity 362-395. Elsevier,754pp.
7- Conrath U. et al.,2015. Annual Review of Phytopathology 53,97-119.
8- Cornè M.J. et al.,2014. Annual Review of Phytopathology 52,347-375.
9- Hannan Parker A.,2022. New Phytologist 233,66-83.
10- Hou K. et al.,2022. Signal Transduction and Targeted Therapy 7,135,1-28.
11- Ibragic S. et al.,2025. Epigenomes 9,10,1-27. MDPI.
12- Illouz-Eliaz et al.,2025. Nature Communications 16,80-95,1-15.
13- Joyous T.J. e J.M. Shah,2022. Biologia 77,2007-2020.
14- Lӓmke J. e I. Bӓurle,2017. Genome Biology 18,124,1-11.
15- Liao C.J. et al.,2022. Current Opinion in Plant Biology 69,102291.
16- Liu L. et al., 2025.Trends in Plant Science 30,4,344-346.
17- Luna E. et al.,2012. Plant Physiology 158,844-853.
18- Luna E. e J. Ton, 2012.Plant Signal & Behaviour 7,6, 615-618.
19 -Mazzucchi U.,1983 In:Callow J.A., Biochemical Plant Pathology, p.299-324. J. Wiley & Sons.
20- Mazzucchi U.,2022. Rivista di Agraria N°362 e 364.
21- Pereira L.B. et al.,2023. Current Opinion in Plant Biology 72,102351,2-10.
22- Reimer-Michalski E.M. e U. Conrath, 2016.Seminars in Immunology 28,4,319-327.
23- Saijo Y. et al.,2018. The Plant Journal 93,592-613.
24-Teixeira P.J. et al., 2019.Current Opinion in Microbiology 49,7-17.
25-Trivedi P. et al.,2020. Nature Reviews Microbiology 18,06,607-621.
26- Vandenkoornhuyse P. et al., 2015.New Phytologist 206,1196-1206.
27- Wu W. e G. Fan, 2025. Plant Stress 15,100753,1-11
28- Xiong C. et al.,2021. New Phytologist, 229,1091-1104.
29- Xie S-S. e C-G. Duan, 2023.aBiotech 4,124-139.
30- Xu Q. et al.,2025. Nature Communications 16, Art.6588.
31- Zhu Q.H. et al., 2016.Molecular Plant Microbe Interactions 29,3,187-196.
Glossario
ncRNA : Acido ribonucleico non codificante.
mRNA : Acido ribonucleico messaggero.
siRNA : Acido ribonucleico di interferenza.
PTI: Pattern Triggered Immunity- Prima fase della risposta immunitaria innata delle piante.
ETI: Effector Triggered Immunity- Seconda fase della risposta immunitaria innata delle piante (integra PTI)
MAMPs: Microbe-Associated Molecular Patterns.
MTI: MAMP–Triggered innate Immunity.
Non-self: Una biomolecola o un organismo che la pianta percepisce essere di diversa origine o in condizione differente dal normale, riconosciuti durante la propria attività metabolica per conservare la omeostasi.
Riconoscimento in negativo: Una cellula tende ad accettare e a integrarsi funzionalmente con l’entità non-self fino a che non riceve un segnale negativo di incompatibilità.
Riconoscimento in positivo: Una cellula continua a considerare la entità come non-self e non si integra fino a che non riceve un segnale positivo di compatibilità.
Umberto Mazzucchi è stato professore ordinario di Patologia Vegetale alla Università degli Studi di Bologna dal 1989 al 2010. Docente del corso di Patologia Vegetale e di alcuni corsi specialistici di materie fitopatologiche, ha svolto ricerche sulle interazioni ospite-patogeno nel processo infettivo e sulla risposta immunitaria delle piante.
Pensionato dal 2010, come professore dell’Alma Mater ha svolto seminari occasionali e cicli di lezioni in corsi ufficiali della Università di Bologna.