di Giuseppe Iannella
Nell’Enciclopedia Dairy Sciences 2nd edn (2011) è riportato che il latte di cavalla non è adatto alla caseificazione.
A differenza di altri tipi di latte, il formaggio non è prodotto con latte equino perchè non coagula con l’ aggiunta di caglio.
Questo è dovuto alla particolare composizione caseinica del latte di cavalla che rende inefficiente la tradizionale coagulazione renninica. Ricerche scientifiche mostrano che la chimosina di vitello nel latte di cavalla idrolizza il legame Phe97-Ile 98 della κ- caseina equina ma questa idrolisi è considerevolmente più lenta di quella della κ-caseina bovina e senza formare un gel.
Tuttavia, l’autore ha sorprendentemente scoperto che la chimosina pura di cammello è in grado di cagliare efficacemente il latte di asina e più recentemente anche quello di cavalla, come precedentemente aveva assunto, essendo questi latti molto simili. Questo lavoro, nella seconda parte, ha lo scopo di mostrare un esempio di tecnologia di caseificazione del latte di cavalla attraverso l’uso di chimosina pura di cammello. Le prove di caseificazione del latte di cavalla con chimosina pura di cammello hanno dato una resa in formaggio fresco del 4 %, quindi relativa al contenuto in caseine e grassi del latte di cavalla. Il basso valore di pH nel formaggio, dopo 10 minuti dalla produzione (pH10 min 5.16), mostra l’ efficiente attività delle colture starter acidificanti nel latte di cavalla e permette una buona protezione contro i microrganismi indesiderati. La procedura riportata nell’articolo rappresenta una informazione di base del processo di caseificazione e può essere impiegata per trasformazione in scala industriale del latte di cavalla in formaggio. Sono necessarie ulteriori ricerche per studiare il meccanismo della coagulazione enzimatica del latte delle Equidae, di utilizzare il siero prodotto durante la caseificazione e infine per valutare se formaggi e derivati delle Equidae possono essere destinati alle persone allergiche agli altri alimenti ad es. ad altri prodotti lattiero-caseari.
Introduzione
Le proprietà nutrizionali e terapeutiche del latte di cavalla (Equus caballus) sono conosciute fin dai tempi antichi secondo lo storico Erodoto (V secolo AC). Sebbene il latte di cavalla ha una minore importanza in comparazione al latte di bovina, bufala, pecora e capra, è tradizionalmente importante in Mongolia e negli stati meridionali della ex Unione Sovietica, ad esempio, il Kazakistan, il Kirghizistan e il Tagikistan.
Poichè il latte equino assomiglia al latte materno per molti aspetti ed è conosciuto per avere particolari proprietà terapeutiche, sta diventando sempre più importante in Europa (Uniacke-Lowe et al, 2010). Le stime indicano che più di 30 milioni di persone al mondo bevono regolarmente latte equino, con un trend in aumento (Doreau & Martin-Rosset, 2002).
Koumiss (latte fermentato acido-alcolico di cavalla) è usato in Russia e Mongolia per la gestione delle malattie digestive e cardiovascolari (Lozovich, 1995). Si deve notare che un rilevante utilizzo del latte delle Equidae domestiche avviene anche in cosmetologia.
Il latte di cavalla e di asina (Equus asinus) è stato utilizzato con successo come un alimento alternativo per bambini con allergie alimentari, ad esempio, l’allergia alle proteine del latte vaccino (CMPA) (Polidori and Vincenzetti, 2013), un’allergia alimentare comune durante l’infanzia con una prevalenza di circa il 3% durante i primi 3 anni di vita; ma la tollerabilità deve essere prima testata (Businco et al., 2000; Salimei et Fantuz, 2012 ). Studi clinici successivi hanno mostrato risultati interessanti sulla tollerabilità del latte delle Equidae che sono molto probabilmente legate alle differenze filogenetiche con i ruminanti (Restani et al, 2009;Salimei et Fantuz, 2012). Tuttavia, i risultati relativi alla tollerabilità del latte delle Equidae non possono essere considerati conclusivi (Iacono et al., 1992; Vita et al., 2007; Salimei et Fantuz, 2012).
Il latte di cavalla forma un debole coagulo in ambiente acido e questo viene sfruttato nella produzione di prodotti yogurt-tipo soprattutto nei Paesi Bassi, dove è aromatizzato con estratti di frutta (Uniacke-Lowe et al, 2010);bevande tradizionali fermentate di latte di cavalla (airag e koumiss) sono molto popolari nelle aree della steppa Eurasiatica (Uniacke-Lowe, 2011b).
Precedenti ricerche relative alla coagulazione renninica del latte delle Equidae riportate nella prestigiosa Encyclopedia of Dairy Sciences 2nd edn (Uniacke-Lowe T and Fox PF, 2011b) mostrano che il latte di cavalla non forma nessun gel con chimosina bovina mentre il latte di asina forma solo un debolissimo gel e che quindi il latte delle Equidae non è adatto alla caseificazione. Nella letteratura scientifica e in riviste specializzate del settore non sono riportati metodi di caseificazione con il 100% di latte delle Equidae eventuali altri metodi dovranno pertanto essere verificati.
Tuttavia, l’autore ha sorprendentemente scoperto che la chimosina di cammello è in grado di cagliare il latte di asina in modo efficiente con un adeguato processo tecnologico (Iannella, 2015c) e più recentemente ha confermato lo stesso risultato nel latte di cavalla (Iannella, 2015b) come egli aveva precedentemente ipotizzato, perché questi latti sono molto simili; questa scoperta ha aperto definitivamente la possibilità di utilizzare il latte delle Equidae domestiche per la produzione del formaggio.
Produzione del formaggio e applicazione degli enzimi
La produzione del formaggio rappresenta una delle prime applicazioni biotecnologiche degli enzimi (Szécsi, 1992).
I principi attivi di questo processo sono gli enzimi proteolitici pepsina e chimosina, precedentemente denominati “caglio”(Foltmann, 1966). Sia chimosina che pepsina appartengono alla stessa famiglia di enzimi e sono definiti come aspartico-proteasi la loro sequenza è identica per il 55% (Langholm Jensen et al. 2013). La chimosina è prevalente nello stomaco dei mammiferi neonati a differenza della pepsina che predomina nello stomaco dei mammiferi adulti.
L’industria lattiero-casearia caratterizza gli enzimi del caglio utilizzando due proprietà. La prima, è l’attività coagulante (C) espressa in IMCU (International Milk Clotting Units). E’ determinata da una metodica analitica standard (International Dairy Federation, 2007) ed esprime la capacità di coagulare il latte, mediante l’idrolisi del legame Phe105-Met106 della κ-caseina o legami vicini. La seconda proprietà è l’attività proteolitica generale (P), che è la capacità di rompere ogni legame della caseina (Kappeler et al., 2006). Il rapporto tra le due proprietà, C/P, indica la qualità di un enzima coagulante. Maggiore è il valore migliore è il coagulante; da questo punto la chimosina è superiore a tutti gli altri enzimi del caglio conosciuti (Foltmann, 1992). Il rapporto C/P della chimosina bovina verso il latte bovino è superiore a quelle delle chimosine di agnello, maiale, gatto e foca (Foltmann, 1970).
La chimosina bovina è l’enzima preferito nel processo di caseificazione, poiché ha una elevata specificità per la k-caseina, l’attività proteolitica generale, soprattutto per quanto riguarda le proteine del latte, è bassa, e l’attività ottimale viene raggiunta in condizioni moderatamente acide (Williams et al., 1997 ).
Tuttavia, la chimosina di cammello espressa in Aspergillus niger mostra un rapporto C /P sette volte più alto della chimosina bovina (Kappeler et al, 2006). Chimosina bovina e di cammello sono entrambe costituite da 323 residui e mostrano una elevata identità di sequenza (85%; Langholm Jensen et al 2013). Tuttavia la chimosina bovina mostra una bassa attività di coagulazione verso il latte di cammello (Farah & Bachmann, 1987; Kappeler et al., 2006); molto probabilmente a causa di notevoli variazioni tra le strutture primarie di k-caseina tra le due specie (Kappeler et al., 1998).
Altre aspartico-proteasi, come pepsina e peptidasi microbica, presentano una più ampia attività proteolitica e sono meno adatte per la produzione di formaggio, poiché formano per azione proteolitica peptidi idrofobici, amari , che pregiudicano il valore sensoriale del formaggio (Kappeler et al., 2006 ).
Nel latte bovino, la chimosina idrolizza il legame Phe105-Met106 della κ-caseina o legami vicini (Fox & McSweeney, 1998). Come risultato, le micelle perdono la loro stabilizzazione sterica e si aggregano, in particolare in presenza di Ca2 + (Walstra, 1990; Walstra et al, 2006), determinando così la formazione di un gel e la separazione di fase del latte in cagliata e siero.
Nel latte equino (latte di cavalla) con chimosina di vitello avviene l’idrolisi del legame Phe97-Ile98 della κ- caseina equina (Egito et al., 2001), ma questa idrolisi è notevolmente più lenta della κ-caseina bovina (Kotts et Jenness, 1976) e senza formazione di un gel (Uniacke-Lowe e Fox, 2011). In aggiunta Egito et al. (2001) hanno verificato che anche la β-caseina equina è prontamente idrolizzata dalla chimosina di vitello a livello del legame Leu190-Tyr191, tuttavia questa idrolisi avviene più lentamente della κ-caseina bovina (Uniacke-Lowe et al. 2013).

Si vede chiaramente nel grafico che non si forma nessun gel nel latte equino, a causa della mancanza di un aumento del modulo di taglio, G ‘. Il latte asinino sembra formare un gel anche se è molto debole rispetto al gel formatosi nel latte bovino e tuttavia senza formazione della cagliata.
A causa delle caratteristiche chimico-fisiche del latte delle Equidae non sorprendente più che la maggior parte dei sistemi pastorali hanno prodotto almeno un tipo di formaggio per ogni specie lattifera invece non esistono metodi tradizionali per la produzione di formaggi con solo latte di cavalla o di asina.
Tuttavia fino ad oggi, oltre a bevande fermentate, solo attraverso una fermentazione lattica o ad una coagulazione termo-acida si possono produrre latticini con latte delle Equidae, ad esempio latticini prodotti con ceppi di batteri lattici, mesofili o termofili, ma eventualmente trattati con agenti addensanti; tuttavia questi prodotti hanno caratteristiche chimiche, organolettiche e reologiche diverse dal formaggio che è ottenuto con l’uso di enzimi coagulanti.
Nuove conoscenze relative alla coagulazione del latte delle Equidae: scoperta di Iannella
Un passo decisivo nella possibilità di utilizzare il latte delle Equidae nel settore lattiero-caseario, per la produzione di formaggio, è stato fatto recentemente grazie alla sorprendente scoperta del tecnologo alimentare italiano, Iannella (2014), che ha scoperto che la chimosina pura di cammello (FAR-M®), enzima estratto dal caglio di cammello, è in grado di coagulare efficacemente il latte di asina, in un appropriato processo tecnologico, che esclude trattamenti termici di termizzazione o pastorizzazione del latte per non inibire la successiva reazione enzimatica (Iannella, 2014). Scoperta pubblicata da Iannella attraverso la multinazionale biotecnologica Chr Hansen Co. che produce l’enzima (Chr Hansen Co. et Iannella, 2015) e attraverso giornali scientifici ( Iannella 2015a, Iannella,2015c).
Più recentemente Iannella (2015b) ha verificato che anche il latte di cavalla è efficacemente coagulato con chimosina pura di cammello (FAR-M®), nelle stesse condizioni operative utilizzate per cagliare il latte d’asina; ipotesi e trovato nei confronti del latte di cavalla pubblicato da Iannella in Dairy Reporter attraverso il giornalista Astley (2015; 2015b).
Per questo motivo la chimosina pura di cammello prodotta per cagliare il latte di cammello (Bruntse, 2011), può essere utilizzata con il metodo di Iannella anche per la produzione del formaggio con latte di asina (Iannella, 2014; Chr Hansen Co et Iannella, 2015; Iannella,2015a; Iannella,2015c) e ora anche quello di cavalla (Iannella,2015b).
Purtroppo, non sono ancora conosciute completamente le interazioni che avvengono tra le micelle caseiniche e la chimosina e in particolare le interazioni tra la chimosina pura di cammello con le micelle caseiniche del latte delle Equidae.
Tuttavia, senza volersi legare ad alcuna teoria, empiricamente, Iannella dimostra che una cagliata consistente si forma quando il latte di cavalla crudo viene trattato con chimosina pura di cammello (FAR-M®) in un adeguato procedimento caseario (Iannella, 2015b), perché l’autore in aggiunta ha verificato che il latte di cavalla sottoposto ad un precedente trattamento termico, pastorizzazione o anche lieve termizzazione, non dava nessun coagulo.
Iannella afferma che il riscaldamento del latte delle Equidae è il punto più critico del processo di caseificazione, che per questo motivo deve avvenire in modo delicato per esempio in un bagnomaria termostatato. Attraverso le sue prove sperimentali ha verificato che la temperatura dell’acqua del bagnomaria non dovrebbe superare 43 °C per non inibire la successiva reazione enzimatica.
Pertanto utilizzando la chimosina pura di cammello (FAR-M®) in un adeguato processo tecnologico caseario, “Nativity-equid cheese making method di Giuseppe Iannella©”, si può ora produrre formaggio con solo latte di asina o di cavalla.
Bisogna ricordare che le prime promettenti applicazioni industriali della chimosina di cammello sono state segnalate da Kappeler et al. (2006), che sostengono che la chimosina ricombinante di cammello espressa in Aspergillus niger rivela proprietà superiori alla chimosina bovina
Nel loro studio è riportato che la chimosina di cammello mostrata un’attività coagulante maggiore per il latte bovino e ha solo il 20% dell’attività proteasica non specifica della chimosina bovina, con un rapporto C /P sette volte più alto della chimosina bovina. Analisi di cinetica enzimatica mostrano che la metà della saturazione è raggiunta con meno del 50% del substrato richiesto per la chimosina bovina. (Kappeler et al. 2006).
Langholm Jensen et al (2013) nel loro studio “Chimosina di cammello e bovina: relazioni tra le loro strutture e le proprietà di caseificazione ” riportano che la chimosina di cammello e quella bovina hanno la stessa piegatura generale, fatta eccezione in un punto. Questa differenza porta ad un aumento della flessibilità dell’enzima di cammello. Variazioni nella sequenza degli amminoacidi, che delimitano la parte che lega il substrato, nella chimosina di cammello, migliorano la capacità di accogliere il substrato. Entrambi gli enzimi possiedono gruppi carichi positivamente sulla loro superficie che possono giocare un ruolo nelle interazioni con la carica negativa C-terminale della k-caseina. La chimosina di cammello tuttavia contiene due gruppi positivi supplementari che favoriscono le interazioni con il substrato. Il miglioramento delle interazioni elettrostatiche derivanti dalla variazione delle cariche superficiali e la maggiore duttilità contribuiscono alla migliore attività coagulante della chimosina di cammello verso il latte bovino (Langholm Jensen et al. 2013).
Mentre il latte crudo di cammello non coagula con chimosina bovina (FAO, 2001; Ramet, 2001) invece è stata trovata una elevata attività di coagulazione con chimosina pura di cammello (Kappeler et al., 2006).
Tuttavia, la capacità della chimosina pura di cammello (FAR-M®) di coagulare efficacemente il latte delle Equidae cioè di asina (Iannella, 2014) e di cavalla (Iannella,2015b; Iannellac) è stato un risultato sorprendente, perché la k-caseina è presente solo in tracce nelle micelle caseiniche del latte di asina (Amadoro et al, 2011) e in piccoli quantitativi nel latte di cavalla (Malacarne et al., 2002); normalmente la k-caseina rappresenta la proteina chiave nel processo di coagulazione dei comuni latti in seguito all’azione della chimosina.
Questo risultato secondo Iannella dovrebbe aprire uno studio dettagliato sull’attività della chimosina di cammello nel latte delle Equidae. Bisogna ricordare che ricerche precedenti mostrano che il latte di asina sotto l’azione di chimosina bovina forma un gel molto debole rispetto a quello formato nel latte bovino trattato in condizioni simili (Uniacke-Lowe e Fox, 2011) e senza formare la cagliata, invece il latte di cavalla con chimosina di vitello non mostrava nessun incremento di gelificazione (Uniacke-Lowe e Fox, 2011).
Tenendo conto della complessità delle micelle caseiniche del latte delle Equidae e ai risultati delle ricerche descritte sopra, Iannella ipotizza che la migliore attività di coagulazione della chimosina di cammello, rispetto alla chimosina bovina, nel latte delle Equidae, può essere attribuito alle variazioni della carica superficiale a livello dei siti di legame con il substrato che facilitano l’associazione tra la chimosina di cammello e le frazioni di caseina e anche alla maggiore flessibilità della chimosina di cammello nella capacità di accogliere il substrato.
La stabilità delle micelle di caseina nel latte di cavalla, in sostituzione alla mancanza di κ-caseina, è attribuita a β-caseine non fosforilate presenti sulla superficie della micelle (Ochirkhuyag et al. 2000; Doreau e Martin-Rosset, 2002), quindi Iannella ipotizza che la proteina chiave nel processo di coagulazione del latte di cavalla con chimosina di cammello è essenzialmente la β-caseina.
Tuttavia, oltre alla k-caseina altre frazioni di caseina (αs1, αs2, β-caseine) e anche α-lattoalbumina possono essere idrolizzate dalla chimosina nel latte bovino (Carles e Ribadeau Dumas, 1985; Miranda et al, 1989) ma ad una velocità molto più lenta rispetto all’idrolisi della κ-caseina, quindi Iannella ipotizza che anche alcune di queste frazioni presenti nel latte di cavalla sono suscettibili all’idrolisi con chimosina di cammello, sebbene con una minore intensità, comunque contribuendo alla formazione della cagliata. Iannella ipotizza che l’assenza di coagulo nel latte delle Equidae trattato termicamente (termizzato, pastorizzato o riscaldato con il metodo tradizionale sul fuoco) è dovuta al cambiamento della conformazione spaziale delle proteine (β-caseina e altre frazioni) in risposta a questo processo, che inibisce l’interazione “chiave-serratura” tra chimosina di cammello con le frazioni di caseina coinvolte nel processo di coagulazione. Per questo motivo per scaldare il latte delle Equidae è necessario utilizzare un metodo “soft” (ad esempio in un bagnomaria a 43°C) secondo l’autore.
Caseificazione del latte di cavalla
Il miglioramento della gestione dell’allevamento delle Equidae domestiche, che ha migliorato la quantità e la qualità del latte prodotto, in combinazione con il crescente interesse per il loro latte grazie alle rinomate proprietà nutraceutiche ha creato l’interesse di produrre formaggio di cavalla.
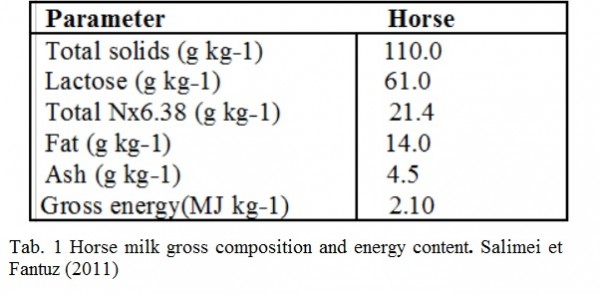
Tuttavia, la trasformazione del latte delle Equidae domestiche in formaggio è tecnicamente più difficile del latte delle altre specie lattifere. Ciò è dovuto al tipo di caseina e anche al basso contenuto in solidi totali e in caseina (Tab.1).
Il processo di produzione è schematizzato in Fig.1 ed è descritto nel paragrafo successivo.


Materiali e metodi
Campioni
Latte crudo intero di cavalla è stato prelevato presso un allevamento italiano. I campioni di latte non erano refrigerati e le prove di caseificazione sono state avviate entro 2 ore dalla mungitura.
Coagulante
E’ stata utilizzata chimosina pura di cammello, chiamata FAR-M® (2011) e prodotta da Chr Hansen ©; in forma polverulenta e altamente stabile. Dosaggio utilizzato in tutte le prove è stato di 0,4 g/5 L di latte di cavalla.
Coadiuvante
Sono state utilizzate per l’acidificazione del latte colture starter termofile normalmente utilizzate per produrre formaggi freschi (liofilizzato DVS di L. delbrueckii ssp. Bulgaricus e S. thermophilus). Dosaggio utilizzato come indicato sulla confezione.
Metodo
Sono state condotte due prove di caseificazione, una prova al giorno per due giorni consecutivi. Il latte di cavalla, conservato a temperatura ambiente, è stato posto in un contenitore di acciaio inox e riscaldato a 37 ° C in un bagnomaria contenente acqua a 43 ° C. Una volta raggiunta la temperatura di 35-37°C il latte è stato inoculato con colture starter (L. delbrueckii ssp. Bulgaricus e S. thermophilus), dopo 1 ora è stata aggiunta chimosina pura di cammello, FAR-M® (0,4 g / 5 L di latte di cavalla).
Il latte è stato incubato per circa 6 h, a temperatura controllata di 35-37 ° C. Dopo la formazione della cagliata, presente sul fondo del contenitore, la maggior parte del siero è stato rimosso quindi la cagliata è stata tagliata e poi il siero residuo allontanato.
La cagliata è stata posta negli stampi e leggermente pressata a temperatura ambiente. Il formaggio fresco così ottenuto è stato mantenuto nello stampo, conservato a 8° C e poi pesato.
Valutazione chimico-fisica del formaggio fresco di cavalla
Resa casearia
Resa casearia (dopo 12 h nello stampo) è stata calcolata usando una bilancia analitica, ed è stata espressa come percentuale.
Resa formaggio( %) = peso di formaggio (g) / peso del campione di latte (g) x100.
pH
Il pH è stato misurato utilizzando un pH-metro (Hanna Instruments HI221 pH / mV / ORP), dopo 10 minuti che il formaggio era nello stampo
Analisi statistiche
I risultati dei test sono stati espressi come media ± deviazione standard (SD) dei due test utilizzando Excel 2010 come programma statistico.
Risultati
Il coagulo ottenuto dopo 6 h dall’aggiunta di chimosina pura di cammello (FAR-M®), in ambiente sub-acido, prodotto dalle colture starter, era un precipitato sotto forma di una cagliata con proprietà di elasticità e malleabilità.
La chimosina pura di cammello utilizzata in queste prove, FAR-M®, quindi è in grado di consentire la produzione di formaggio con latte di cavalla nelle dosi di 0,4 g /5 L di latte.
| Tab. 2 Parametri chimico-fisici (Media±SD) del formaggio di cavalla | |
| Parametro | Valore |
| pH 10min | 5.16±0.14 |
| Resa dopo 12 h | 4.04±0.25 |
La tabella 2 mostra alcuni parametri chimico-fisici del formaggio fresco di cavalla; valore di pH dopo 10 minuti e resa in formaggio fresco dopo 12 h.
Le prove di caseificazione utilizzando chimosina pura di cammello (FAR-M®) con il metodo descritto sopra (Fig.1) hanno dato una resa in formaggio fresco di circa il 4% quindi relativa al più basso contenuto in caseine e grassi del latte di cavalla come riportato nella letteratura scientifica (Tab.1).
Il basso valore di pH nel formaggio, dopo 10 minuti dalla produzione (pH a 10 min 5,16; Tab.2), mostra l’efficiente attività delle colture starter nel latte di cavalla e permette una buona protezione contro gli agenti patogeni.
Conclusioni
La produzione del formaggio con il latte di cavalla è fattibile. La resa media del formaggio ottenuto con il latte di cavalla (intorno al 4%) è più bassa di quella riportata in letteratura scientifica ottenuta con latte bovino (circa 10-12%) perché è relativa al più basso contenuto in proteine e grassi del latte di cavalla (Tab. 1), tuttavia il risultato è promettente.
Secondo l’autore questa metodologia può essere opportunamente modificata tuttavia rispettando l’uso di chimosina di cammello come coagulante, l’abbassamento del pH del latte e nessun trattamento termico superiore a circa 43 ° C e che le cagliate ottenute da questi processi possono essere trattate in modo diverso a seconda del tipo di formaggio che si vuole ottenere o essere destinate come ingredienti in diversi alimenti.
Le colture starter aggiunte nel processo sono responsabili della produzione di acido lattico che migliora la consistenza del coagulo e inibisce la crescita dei batteri indesiderati nella cagliata. Inoltre la chimosina pura di cammello in studi precedenti ha mostrato un pH ottimale a 5,1 (Kappeler et al., 2006); per questo motivo il pH del latte deve essere abbassato. Questo dato indica che la caseificazione del latte delle Equidae senza l’utilizzo delle colture starter deve essere scoraggiato.
Iannella ritiene che il riscaldamento del latte delle Equidae alla temperatura di coagulazione (circa 30-40 ° C) è il punto più critico nella lavorazione del formaggio e questo motivo deve avvenire in modo “soft” es in un bagno di acqua e attraverso la sue prove ha verificato che l’acqua del bagnomaria non deve superare circa 43 ° C (Iannella, 2015c).
Questa ricerca rappresenta una importante informazione di base e potrebbe essere sfruttata per la trasformazione del latte di cavalla anche a livello industriale.
Sono necessarie ulteriori ricerche per studiare il meccanismo della coagulazione enzimatica del latte delle Equidae, per migliorare la resa in formaggio, per utilizzare il siero prodotto durante la caseificazione oltre alla produzione di ricotta e infine per valutare se formaggi e derivati delle Equidae possono essere destinati alle persone allergiche agli altri alimenti ad es. ad altri prodotti lattiero-caseari.
Ringraziamenti
Voglio ringraziare Chr Hansen Co. per avermi donato chimosina pura di cammello (FAR-M®) e a Raffaele per avermi donato latte di cavalla.
Grazie alla mia famiglia per avermi sostenuto moralmente ed economicamente in questa ricerca “Coagulazione del latte delle Equidae e sua caseificazione”, essendo questa ricerca non finanziata in alcun modo; come ricercatore privato non dipendente di università o centri di ricerca ho sviluppato tutto da solo.
Spero che questo risultato servirà come incoraggiamento ai giovani scienziati a non cedere per mancanza di molti mezzi.
Consapevole che il mio trovato cambierà le prospettive dell’allevamento delle Equidae per questo importante risultato voglio ringraziare Dio e la Madonna per avermi dato questa inaspettata grazia, per questo motivo, come segno di gratitudine verso Dio ho voluto inserire il termine Nativity al mio metodo: “Nativity -Equid cheese making method ©”
La Natività di nostro Signore ci ha aperto ogni grazia anche nei vasti campi della scienza !!!
“La grandezza dell’uomo risiede nella semplicità del suo pensiero”
Papa emerito Benedetto XVI
Informazioni relative all’autore
Giuseppe Iannella, Tecnologo alimentare iscritto all’albo dei Tecnologi alimentari Lazio-Campania, ha conseguito la laurea Specialistica in Scienze e Tecnologie Alimentari presso l’Università degli studi del Molise nel 2005. Svolge consulenza nel settore agroalimentare, in particolare nel settore lattiero-caseario e della carne. E-mail: foodtech.iannella@gmail.com
Bibliografia
Presente alla fine della corrispondente versione in inglese dell’articolo.
Equine cheese made through pure camel chymosin
Giuseppe Iannella
Encyclopedia of Dairy Sciences 2nd edn (2011) reported that mare’s milk is not suitable for cheese production. Unlike other milk, cheese is not produced from equine milk as no curd is formed on addition of common rennet.
This is due to particular caseinic composition of mare’s milk that makes inefficient the traditional rennet coagulation. Research suggests that mare’s milk with calf chymosin is susceptible to hydrolysis at the Phe97-Ile 98 bond of equine κ- casein but its hydrolysis is considerably slower than that of bovine κ-casein and with out gel formation.
However, the author has surprisingly found that pure camel chymosin is able to clot effectively donkey milk, with an appropriate technological process, and more recently also mare’s milk as he was previously assumed, because these milks are very similar. This investigation, in the second part, is aimed to show an example of cheese making technology of mare’s cheese. Cheese making using pure camel chymosin gave a yield of fresh mare’s cheese about 4 % of then relative to the content of protein and fat of mare’s milk. The low pH in cheese, after 10 min from the production (pH at 10 min 5.16), shows the efficient activity of starter cultures in mare’s milk, and allows a good protection against pathogens agents. This application represents an informative steps for further trials and could be useful for industrial scale cheese processing of mare’s milk.
More research is needed to study the mechanism of enzymatic coagulation in equid milk, to use the nutritious whey that is produced from cheese, and finally assess if cheese and derivatives from equid milk can be addressed, as alternative food for people suffering from food allergies i.e. to other dairy products.
Introduction
The nutritional and therapeutic properties of mare’s milk (Equus caballus) have been known since ancient times according to the historian Erodoto (V century BC).Although horses are of minor importance for milk production in comparison with cows, buffalo, sheep and goats, they have been traditionally important dairy animals in Mongolia and in the southern states of the former Soviet Union, e.g., Kazakhstan, Kyrgyzstan and Tajikistan.
Because equine milk resembles human milk in many respects and is claimed to have special therapeutic properties, it is becoming increasingly important in Europe (Uniacke-Lowe et al, 2010).
Estimates suggest that more than 30million people world wide drink equine milk regularly, with that figure increasing significantly annually (Doreau & Martin-Rosset, 2002).
Koumiss (fermented mare’s milk) is used in Russia and Mongolia for the management of digestive and cardiovascular diseases (Lozovich, 1995). It must be noted that the economically relevant interest in the use of equid milks is also in cosmetology.
Horse and donkey milk (Equus asinus) has been used successfully as an alternative food for infants with food allergies, e.g., cows’ milk protein allergy (CMPA) (Polidori and Vincenzetti, 2013), a common food allergy in childhood with a prevalence of approximately 3% during the first 3 years of life; but tolerability must be tested first (Businco et al., 2000; Salimei et Fantuz, 2012 ). Subsequent clinical studies showed interesting results on equid milk tolerability most likely related to horse and donkey phylogenetic differences with ruminants. (Restani et al, 2009; Salimei et Fantuz, 2012). However, results on equid milk tolerability cannot be considered conclusive (Iacono et al., 1992; Vita et al., 2007). Equid milk will form a weak coagulum under acidic conditions and this is exploited in the production of yoghurt-type products, especially in the Netherlands, where it is generally flavoured with concentrated fruit extract (Uniacke-Lowe et al, 2010); traditional fermented horse milk beverages (airag and koumiss) are very popular in Eurasian steppe areas (Uniacke-Lowe, 2011b).
Previous research on rennet-induced coagulation of equid milk reported in Encyclopedia of Dairy Sciences 2nd edn (Uniacke-Lowe T and Fox PF, 2011b) show that horse milk does not form a gel during renneting, by bovine chymosin, and donkey milk, although coagulable forms a very weak gel and that equid milk is not suitable for cheese production. In scientific literature and in trade magazines are not reported methods of cheese making with 100% of equid milk any other methods will therefore be verified.
However, the author has surprisingly found that pure camel chymosin is able to clot effectively donkey milk, with an appropriate technological process (Iannella,2015c), and more recently also mare’s milk (Iannella, 2015b) as he was previously assumed, because these milks are very similar; therefore this discovery has opened definitively the possibility of using equid milk for cheese production.
Cheese production and applications of enzymes
Cheese production represents one of the earliest biotechnological applications of enzymes (Szecsi, 1992).
The active ingredients in this process were identified as the proteolytic enzymes pepsin and chymosin, previously referred to as ‘rennet’ (Foltmann, 1966). Both chymosin and pepsin belong to the pepsin-like family of aspartic peptidases and their sequences are 55% identical (Langholm Jensen et al. 2013). Chymosin is prevalent in the stomach of newborn mammals unlike pepsin predominates in adult mammals.
The dairy industry characterizes rennet enzymes using two properties. The first is the milk-clotting activity (C) expressed in International Milk-Clotting Units (IMCU). It is determined by a standard method (International Dairy Federation, 2007) that describes the ability to aggregate milk by cleaving the Phe105-Met106 bond or nearby bonds of κ-casein. The second property is the general proteolytic activity (P), which is the ability to cleave any bond in casein (Kappeler et al., 2006). The ratio between the two properties, the C/P ratio, captures the essential quality of a milk-clotting enzyme. The higher the value the better the rennet, and in this regard chymosin is superior to all other known rennet enzymes (Foltmann, 1992).
The C/P ratio of bovine chymosin towards bovine milk is higher than those of the chymosins from lamb, pig, cat and seal (Foltmann, 1970).
Bovine chymosin is the preferred enzyme in the cheesemaking process, since specificity for K-casein is high, general proteolytic activity, especially with regard to milk proteins, is low, and optimal activity is achieved at mildly acidic conditions (Williams et al.,1997).
However, camel chymosin expressed in Aspergillus niger shows a sevenfold higher C/P ratio than bovine chymosin (70% higher clotting activity and only 25% of the general proteolytic activity; Kappeler et al., 2006). Bovine and camel chymosin both consist of 323 residues and display high sequence identity (85%; Langholm Jensen et al. 2013). In contrast, bovine chymosin displays a very low milk-clotting activity towards camel milk (Farah & Bachmann, 1987;Kappeler et al., 2006); most likely due to major variations between the primary k-casein structures of the two species (Kappeler et al., 1998).
Other aspartic proteases, such as pepsin and microbial peptidases, exhibit a broader proteolytic activity and are less suitable for cheese production, since bitter, hydrophobic peptides, formed by undesirable proteolytic action, impair the sensory value of the cheese (Kappeler et al., 2006).
In bovine milk with rennet, chymosin hydrolyses the Phe105-Met106 bond of κ-casein or nearby bonds (Fox & McSweeney, 1998). As a result, the micelles lose steric stabilization and become susceptible to aggregation, particularly in the presence of Ca2+ (Walstra, 1990; Walstra et al., 2006), thereby leading to gel formation and phase separation of the milk into curds and whey.
Equine milk (mare’s milk) with calf chymosin is susceptible to hydrolysis at the Phe97-Ile98 bond of equine κ- casein (Egito et al., 2001), but its hydrolysis is considerably slower than that of bovine κ-casein (Kotts et Jenness, 1976) and with out gel formation (Uniacke-Lowe and Fox, 2011). In addition Egito et al. (2001) have verified that also equine β-casein is hydrolysed by calf chymosin at Leu190-Tyr191, however this hydrolysis occurred at a much slower rate compared to that of bovine κ-casein (Uniacke-Lowe et al. 2013).
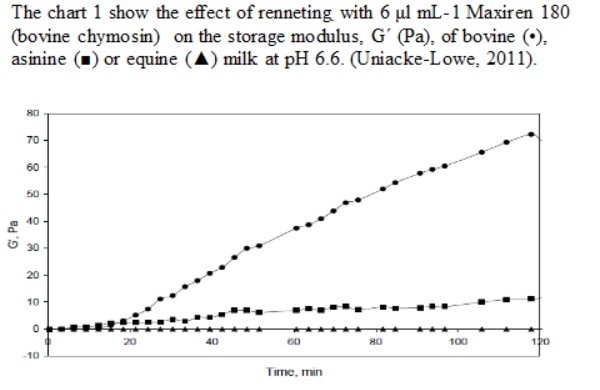
It is clearly seen in the graphs that no gel is formed from equine milk, as judged by lack of an increase in storage modulus, G’. Asinine milk seems to form a gel although it is very weak compared to the gel formed on bovine milk and with out curd formation.
Therefore, it is not surprising that the majority of pastoral systems have produced at least one type of cheese, no traditional methods exist for making cheese from 100% of mare’s milk. However, until today, besides the traditional fermented horse milk beverages (airag and koumiss) only through lactic fermentation or thermo-acid coagulation could produced a dairy product from equid milk i.e. dairy product with strains of lactic acid bacteria, mesophilic or thermophilic, optionally thickened with thickening agent, but these products have different chemical, organoleptic and rheological characteristics of the cheese that is obtained with the use of coagulating enzymes.
New knowledge of coagulation equid milk: Iannella finds
A decisive step in the possibility to use equid milk in the dairy sector, for cheese production, has been made thanks to the surprising finding of the italian food technologist, Iannella (2014), which has discovered that pure camel chymosin (FAR-M®), enzyme found in camel rennet, is able to clot effectively donkey milk with an appropriate technological process, which excludes thermal treatment of thermization or pasteurization of milk in order to not inhibit the subsequent enzymatic reaction (Iannella, 2014). Discovery published by Iannella through the multinational biotechnology company Chr Hansen (Chr Hansen Co. and Iannella, 2015) and through scientific journal ( Iannella 2015a, Iannella,2015c).
More recently Iannella (2015b) has verified that also mare’s milk are effectively coagulated by pure camel chymosin (FAR-M®), under the same operating conditions used by him to curdle donkey milk; hypothesis and found towards mare’s milk published by Iannella in Dairy Reporter through the journalist Astley (2015; 2015b).
For this reason pure camel chymosin now used to curdle camel milk (Bruntse, 2011), can also be used with Iannella method for donkey cheese production (Iannella, 2014; Chr. Hansen Co and Iannella, 2015; Iannella,2015a; Iannella,2015c), and now also for mare’s cheese production (Iannella,2015b).
Unfortunately, computational methods for proteins have not yet reached a state that enables the modelling of the interactions of an entire casein micelle with chymosin, in particular the pure camel chymosin with casein micelles of equid milk.
However, without wishing to be bound to any theory empirically is contemplated that curd firmness is formed when raw mare’s milk is treated with pure camel chymosin (FAR-M®), with a proper dairy technology process because Iannella (2015b) found that mare’s milk subjected to a prior heat treatment, pasteurization or also slight thermization, did not give a clot, as he had previously seen in donkey’s milk.
Iannella states that the heating of equid milk is the most critical point in the process of cheese production, that for this reason must take place in a “soft way” e.g. in a water bath and through its empirical testing has verified that the water temperature of the water bath should not exceed about 43°C (Iannella,2015c).
Therefore using pure camel chymosin (FAR-M®) in an appropriate technological process, with Iannella method named “Nativity- equid cheese making method ©”, one can now produce cheese with 100% of equid milk ( donkey or mare’s milk).
One must remember that the promising industrial applications of camel chymosin were first reported by Kappeler et al. (2006), who claim that recombinant camel chymosin expressed in Aspergillus niger reveals superior properties of bovine chymosin. In their study is reported that camel chymosin exhibits a 70% higher clotting activity for bovine milk and has only 20% of the unspecific protease activity for bovine chymosin. This results in a sevenfold higher ratio of clotting to general proteolytic activity. Kinetic analysis showed that half-saturation is achieved with less than 50% of the substrate required for bovine chymosin and turnover rates are lower (Kappeler et al. 2006). Langholm Jensen et al (2013) in their work “Camel and bovine chymosin: the relationship between their structures and cheese-making properties” have reported that camel and bovine chymosin share the same overall fold, except for the antiparallel central β-sheet that connects the N-terminal and C-terminal domains. In bovine chymosin the N-terminus forms one of the strands which is lacking in camel chymosin. This difference leads to an increase in the flexibility of the relative orientation of the two domains in the camel enzyme. Variations in the amino acids delineating the substrate-binding cleft suggest a greater flexibility in the ability to accommodate the substrate in camel chymosin. Both enzymes possess local positively charged patches on their surface that can play a role in interactions with the overall negatively charged C-terminus of k-casein. Camel chymosin contains two additional positive patches that favour interaction with the substrate. The improved electrostatic interactions arising from variation in the surface charges and the greater malleability both in domain movements and substrate binding contribute to the better milk-clotting activity of camel chymosin towards bovine milk. (Langholm Jensen et al. 2013).
While raw camel milk cannot be clotted with bovine chymosin (FAO, 2001; Ramet, 2001 ), a high clotting activity was found with camel chymosin (Kappeler et al., 2006).
However the ability of pure camel chymosin (FAR-M®) to clot equid milk i.e. donkey and mare’s milk (Iannella,2015b; Iannellac) was a surprising found because as mentioned k-casein is present in trace amounts in casein micelles of asses’ milk (Amadoro et al., 2011), and small quantities in horse (Malacarne et al., 2002); normally k-casein represents the key protein of coagulation process by chymosin in common milks. One must remember that preliminary research, suggests that asinine milk under the action of bovine chymosin, forming a very weak gel, compared to bovine milk under similar conditions (Uniacke-Lowe and Fox, 2011) and with out curd formation, indeed mare’s milk with calf chymosin does not show gel formation (Uniacke-Lowe and Fox, 2011).
This interesting result according Iannella should open a detailed study on the activity of camel chymosin in equid milk.
Taking into account the complexity of casein micelles of equid milk and according to the studies described above, Iannella hypothesizes that the improved milk clotting activity of camel chymosin, compared to bovine chymosin, in equid milk can be attributed to variations on the surface charge, at the binding sites, that facilitate the association between camel chymosin and equid casein and to the improved flexibility of camel chymosin in the ability to accommodate the substrate.
The steric stabilization of casein micelles on mare’s milk, in compensation to the absence of κ-casein, it is given by unphosphorylated β-casein on the micelle surface (Ochirkhuyag et al. 2000 ; Doreau and Martin-Rosset, 2002); and then Iannella hypothesizes that the key protein in coagulation process of mare’s milk with pure camel chymosin is β –casein.
However in addition to k-casein other fractions of casein (αs1-, αs2-, and β-caseins) and also α-lactalbumin can be hydrolysed by chymosin in bovine milk (Carles and Ribadeau Dumas, 1985; Miranda et al, 1989) but at a much slower rate than κ-casein, then probably some of these fractions also present in equid milk, they can be hydrolysed by camel chymosin, although to a lesser degree, however contributing to the coagulation of equid milk according Iannella hypothesis.
Iannella hypothesizes the absence of clot in equid milk heat-treated (thermised , pasteurized or heated with the traditional method on the fire) is due to the change of spatial conformation of proteins (β –casein and others) in response to this process, that inhibits the interaction “key-lock” between camel chymosin with fractions of casein involved in the clotting process. For this reason to warm equid milk you have to use soft method (e.g. in a water bath at 43°C).
Mare’s cheese manufacturing
The processing of equid milk (mare’s and donkey milk) into cheese is technically more difficult than milk from other domestic dairy species. This is mainly due to its low total solids content, and different casein content (Tab.1).
This investigation, in this section, is aimed to show an example of cheese making technology of mare’s cheese.
The flow steps for the manufacturing of cheese are summarized in Figure 1. The process is described in the following paragraph.

Materials and methods
Sample
Whole raw mare’s milk was obtained from a Italian farm. Mare milks samples they were not refrigerated. Tests were started within 2 h from collection.
Coagulant
Pure camel chymosin, named FAR-M® (2011) and product from Chr Hansen©, Denmark; product in highly-stable powder. Dosage 0,4 g /5 L of mare milk.
Coadjuvant
Commercial starter culture for fresh cheese (e.g. Freeze-dried DVS of L. delbrueckii ssp. bulgaricus and S. thermophilus); used for milk acidification. Dosage used as indicated on the package.
Method
A total of two trials of cheese-making from mare’s milk were conducted, 1 test per day for 2 consecutive days, to prepare fresh mare cheese. Mare’s milk, kept at room temperature, were taken in a stainless steel container and heated to 37°C in a water bath at 43°C. Then the milk was inoculated with thermophilic starter cultures (L. delbrueckii ssp. bulgaricus and S. thermophilus), after about 1 h was added pure camel chymosin, FAR-M® (0.4 g /5 L of equine milk).
The milk was incubated for about 6 h, at room controlled temperature at 37°C. After the curd formation, most of the whey was removed, and the curd was cut and then the remaining whey was drained off. The curd was moulded and pressed at room temperature. Cheese was kept in the mould, weighed, sampled and stored at 8°C for further evaluation.
Physico-chemical evaluation of fresh mare’s cheese
Cheese yield
Cheese yield (after 12 h in mould) was calculated using an analytical balance, and was expressed as a percentage. Cheese yield % = weight of cheese (g)/weight of the milk sample (g) x100.
pH
pH were measured using pH meter (Hanna Instruments HI221 pH/mV/ORP), after 10min that cheese was in the modules.
Statistical analysis
Test results are expressed as Mean ± Standard deviation (SD) of two test using Excel 2010 as a statistical program.
Results
The coagulum obtained in this process, after 6 h as the addition of pure camel chymosin (FAR-M®), in environment sub-acid product with starter cultures, was a precipitate in the form of clot, with elastic properties.
Then pure camel chymosin utilized in this investigation (FAR-M®) is able to allow the production of mare’s cheese with doses of 0.4g/5 L of milk.
| Tab. 2 Physico-chemical parametres (Mean±SD) of mare cheese. | |
| Parameter | Value |
| pH 10min | 5.16±0.14 |
| Yield at 12 h | 4.04±0.25 |
Table 2 shows some physico-chemical parameters of fresh mare cheese, after 10 min in the mold for pH and after 12 h for yield.
Trials of cheese making using pure camel chymosin (FAR-M® ) in this investigation with the process described above, gave a yield of fresh mare’s cheese (after 12 h in mould) of about 4 % (Tab.2), then relative to the lower content of protein and fat of mare’s milk as reported in scientific literature (Tab. 1). The pH 5,16 (Tab 2) measured in cheese, after 10 min from the production , shows the efficient activity of starter cultures in mare’s milk, and allows a good protection against pathogens agents.
Conclusion
Manufacture of fresh cheese mare’s cheese is feasible. The average cheese yield obtained (around 4%, ) from mare’s milk was lower than that reported in literature for cow milks (around 10-12%) because depending to the lower contents of casein and fat of mare milk (Tab.1) however the result is promising.
Cheese curds obtained by these processes can be treated in different ways according to the type of cheese to be obtained or used as an ingredient in other foods. In any case these methodologies can be appropriately modified but respecting the use of camel chymosin as coagulant and no one heat treatment of thermization or pasteurization.
Iannella finds that the heating of equid milk at the temperature of coagulation (about 30-40°C) is the most critical point in equid cheese processing, that for this reason must take place in a “soft way” e.g. in a water bath and through its empirical testing has verified that the water bath should not exceed about 43°C (Iannella,2015c).
In mare cheese making process, the use of starter cultures is necessary because they are responsible of lactic acid production, which improve curd firmness and suppresses the growth of undesirable bacteria in the curd, obtained from raw milk. In addition the pure camel chymosin have optimum pH at 5.1 (Kappeler et al., 2006), therefore also for this reason the pH of the milk must be lowered. These data indicate that cheese making without use of starter cultures should be discouraged.
This application represents an informative steps for further trials and could be useful for industrial scale cheese processing of mare’s milk.
More research is needed to study the mechanism of enzymatic coagulation in equid species, to improve cheese yield, to use the nutritious whey that is produced from cheese in addition to producing “ricotta”, and finally if cheese and derivatives from equid milk can be addressed, as alternative food for people suffering from food allergies i.e. to other dairy products.
ACKNOWLEDGEMENTS
Thanks of Chr Hansen Co. for giving me pure camel chymosin, FAR-M® and to Raffaele for mare’s milk.
Thanks to my family that supported me morally and economically in this search “Coagulation of Equid milk and its Cheesemaking”, because this research was not funded in any way; as an independent researcher not employed by universities or research centers I developed all by myself.
I hope that this result will serve as encouragement to young scientists to not to surrender for lack of means.
Conscious that my method will definitely change the perspectives of Equidae breeding I want to thank God and Our Lady for giving me the grace to discover the system to coagulate Equid Milk, for this reason, as gratitude for this grace, I wanted to include the term Nativity in my method: “Nativity-Equid Cheese Making Method ©”
The Nativity of our Lord allowed us all grace also in the vast fields of science!!!
“Man’s greatness lies in the simplicity of his thought ”
Pope Emeritus Benedict XVI
References
Amadoro C, Colavita G, Salimei E (2011) Il latte, 35
Astley M (2015). Could FAR-M camel milk coagulant be used to produce horse or zebra cheese? Pure camel chymosin holds the potential to clot milk from other equus animals as well as donkeys, says an Italian food technologist. http://www.dairyreporter.com/R-D/Could-FAR-M-camel-milk-coagulant-be-used-to-produce-horse-or-zebra-cheese. 06-May-2015
Astley M (2015b). Having a mare making horse cheese? Try camel chymosin, says Italian scientis http://www.dairyreporter.com/R-D/Having-a-mare-making-horse-cheese-Try-camel-chymosin-says-Italian-scientist.13-Jul-2015
Bruntse A (2011). Camel cheese Manual PDF. http://www.infonet-biovision.org/
Businco, L., Giampietro, P. G., Lucenti, P., Lucaroni, F., Pini, C., Di Felice, G., et al. (2000). Allergenicity of mare’s milk in children with cow’s milk allergy. Journal of Allergy and Clinical Immunology, 105, 1031e1034
Carles C, Ribadeau Dumas B. (1985). Kinetics of the action of chymosin (rennin) on a peptide bond of bovine αs1-casein (1989). Comparison of the behaviour of this substrate with that of β- and κ caseins. FEBS Lett. 1985, 185, 282−286.
Chr. Hansen Co, Iannella G (2015). From Camel to donkey cheese – FAR-M® creates new business opportunities. http://www.chr-hansen.com/news-media/singlenews/from-camel-to-donkey-cheese-far-mR-m-creates-new-business-opportunities.html, 30-03-2015.
Doreau, M.; Martin-Rosset, W. (2002). Dairy animals | horse. In Encyclopedia of Dairy Sciences; Roginski, H., Ed.; Elsevier: Oxford, UK,2002; pp 630−637.
Egito AS, Girardet J-M., Miclo L, Mollé D, Humbert G, Gaillard J-L(2001). Susceptibility of equine κ- and β-caseins to hydrolysis by chymosin. Int. Dairy J. 11, 885-893.
FAO (2001). The Technology of Making Cheese from Camel Milk (Camelus dromedarius). Animal Production and Health Paper, Vol. 113.Rome: Food and Agriculture Organization of the United Nations.
Farah, Z. & Bachmann, M. R. (1987). Milchwissenschaft, 42, 689–692.
FAR-M® (2011). http://www.chr-hansen.com/products/product-areas/enzymes/our-products/coagulants/far-mr.html
Foltmann B. (1966). A review on prorennin and rennin. C. R. Trav. Lab. Carlsberg 35:143-231.
Foltmann B. (1970). Methods Enzymol. 19: 421–436.
Foltmann B. (1992). Chymosin: a short review on foetal and neonatal gastric proteases. Scand. J. Clin. Lab. Invest. 52:65-79.
Fox P F., McSweeney P (1998). Dairy Chemistry and Biochemistry,ch. 10. Dordrecht: Kluwer Academic Publishers.
Iacono, G., Carroccio, A., Cavataio, F., Montaldo, G., Soresi, M., & Balsamo, V. (1992). Use of ass’s milk in multiple food allergy. Journal of Pediatric Gastroenterology and Nutrition, 14, 177e181.
Iannella G (2014). Coagulation of donkey milk through pure camel chymosin – FAR-M® and donkey cheese. Article recorded by a notary, attesting certain date at 14/07/2014. Available from the author.
Iannella G (2015a) Formaggio con latte di asina ottenuto mediante coagulazione enzimatica con chimosina di cammella
Rivista di Agraria.org N. 212 – 15 maggio 2015. http://www.rivistadiagraria.org/riviste/vedi.php?news_id=686&cat_id=302
Iannella G (2015b). Cheese from mare’s milk through pure camel chymosin– FAR-M® and starter culture in document attesting certain date at 08/07/2015. Available from the author.
Iannella, G. (2015c). Donkey cheese made through pure camel chymosin. African Journal of Food Science, 9(7), 421-425. http://www.academicjournals.org/journal/AJFS/article-abstract/1A3CD2D54274
International Dairy Federation (2007). Determination of Total Milk-clotting Activity of Bovine Rennets. ISO 11815:2007. Geneva: International Organization for Standardization.
Jardali Z, Ramet JP (1991). Composition et taille des micelles du lait de dromedaire. Le lait 65
Kappeler S, Farah Z, Puhan Z (1998). Sequence analysis of Camelus dromedarius milk caseins, J. Dairy Res. 65 (1998) 209–222.
Kappeler S, van den Brink HJ, Rahbek-Nielsen H, Farah Z, Puhan Z, Hansen EB, Johansen E (2006). Characterization of recombinant camel chymosin reveals superior properties for the coagulation of bovine and camel milk. Biochem. Biophys. Res. Commun. 342:647-654.
Kotts C. et Jenness R (1976). Isolation of κ-casein-like proteins from
milk of various species. J. Dairy Sci. 59, 816-822.
Langholm Jensen J, Molgaard A, Navarro Poulsen J-C, Harboe MK, Simonsen JB, Lorentzen, AM, Hjerno K, van den Brink KB, Qvist KB, Larsen S (2013). Camel and bovine chymosin: The relationship between their structures and cheese-making properties. Acta Crystallogr. D Biol. Crystallogr. 2013; 69:901-913.
Lozovich S.(1995).Medical uses of whole and fermented mare milk in Russia. Cultured Dairy Products Journal,30, 18e21.
Malacarne M, Martuzzi F, Summer A, Mariani P (2002). Protein and fat composition of mare’s milk: some nutritional remarks with reference to human and cow’s milk. Int. Dairy J. 12:869-877.
Miranda, G.; Haze, G.; Scanff, P.; Pelissier, J. P. (1989). Hydrolysis of α-lactalbumin by chymosin and pepsin. Effect of conformation and pH. Lait 1989, 69, 451−459.
Ochirkhuyag, B.; Chobert, J.-M.; Dalgalarrondo, M.; Haertlé, T. (2000) Characterization of mare caseins. Identification of α-S1- and α-S2-caseins. Lait 2000, 80, 223−235.
Ramet JP (2001). The technology of making cheese from camel milk (Camelus dromedary). Animal. Production and Health Paper. No. 113. Rome, Italy: F.A.O.
Polidori P, Vincenzetti S. Use of Donkey Milk in Children with Cow’s Milk Protein Allergy. Foods. 2013; 2(2):151-159.
Restani, P., Ballabio, C., Di Lorenzo, C., Tripodi, S., & Fiocchi, A. (2009). Molecular aspects of milk allergens and their role in clinical events. Analytical and Bioanalytical Chemistry, 395, 47e56.
Salimei E, Fantuz F (2012). Equid milk for human consumption Int. Dairy J. 24:130-142
Szecsi PB (1992). The aspartic proteases. Scand. J. Clin. Lab. Invest. 52, 5-22.
Uniacke-Lowe T, Huppertz T and Fox, PF. (2010) Equine milk proteins: Chemistry, structure and nutritional significance, Review. Int. Dairy Journal 20 (2010): 609-629 21)
Uniacke-Lowe T., (2011). Studies on equine milk and comparative studies on equine and bovine milk systems. PhD Thesis, University College Cork
Uniacke-Lowe T. (2011b) Koumiss. In: Encyclopedia of Dairy Sciences, 2nd edn, Vol. 2, Academic Press, San Diego, CA, USA, pp. 512-517.
Uniacke-Lowe T, Fox PF (2011). Equid Milk. University College Cork, Cork, Ireland 2011 Elsevier Ltd, 523
Uniacke-Lowe T, Fox PF (2011b) Equid Milk: Encyclopedia of Dairy Sciences (2nd edn) (Volume 3), Academic Press, San Diego, CA, USA, pp. 518-529
Uniacke-Lowe T, Chevalier F, Hem S, Fox PF and Mulvihill DM (2013) Proteomic Comparison of Equine and Bovine Milks on Renneting J. Agric. Food Chem., 2013, 61 (11), pp 2839–2850
Walstra P (1990). On the stability of casein micelles. J. Dairy Sci. 73:1965-1979.
Walstra P, Geurts TJ, Noomen A, Jellema A, van Boekel MAJS (2006). Dairy Technology:Principles of Milk Properties and Processes. CRC/Taylor Francis. New York.
Williams MG, Wilsher J, Nugent P, Mills A, Dhanaraj V, Fabry M, Sedlacek J, Uusitalo JM, Penttila ME, Pitts JE, Blundell TL (1997). Mutagenesis, biochemical characterization and X-ray structural analysis of point mutants of bovine chymosin, ProteinEng. 10 (1997) 991–997.
Vita D, Passalacqua G, Di Pasquale G, Caminiti L, Crisafulli G, Rulli I, et al. (2007). Ass’s milk in children with atopic dermatitis and cow’s milk allergy: crossover comparison with goat milk. Pediatric Allergy and Immunology, 18, 594e598.
How to cite this Article
Iannella Giuseppe (2015) Equine cheese made through pure camel chymosin- Iannella method. Rivista di Agraria.org (ISSN 1970-2639) N.216, August 2015. URL ..
Copyright © 2015 Author(s) retain the copyright of this article.
Author information
Dr Giuseppe Iannella
Food Technologist
Italy
E-mail: foodtech.iannella@gmail.com
Pec: giuseppe.iannella@postecert.it
|









