di Gennaro Pisciotta
Definiamo il pH una scala di misura dell’acidità o della basicità di una soluzione acquosa. Il termine “pH” fu introdotto nel 1909 dal chimico danese Søren Sørensen.
Il termine p (operatore) simboleggia due operazioni matematiche da effettuare sull’attività dello ione H30+ in soluzione acquosa, ovvero il logaritmo in base 10 dell’attività e quindi il cambio di segno del risultato (moltiplicazione per -1).
Naturalmente, per le proprietà dei logaritmi, si ottiene il medesimo risultato anche calcolando il logaritmo del reciproco dell’attività degli ioni H30+. Benché matematicamente non corretto, è prassi, per brevità, omettere l’indicazione della concentrazione unitaria nell’argomento del logaritmo (sottintendendone la presenza) e scrivere il pH semplicemente come:
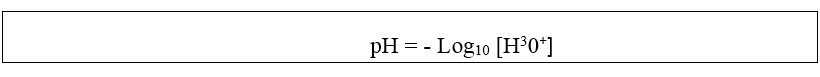
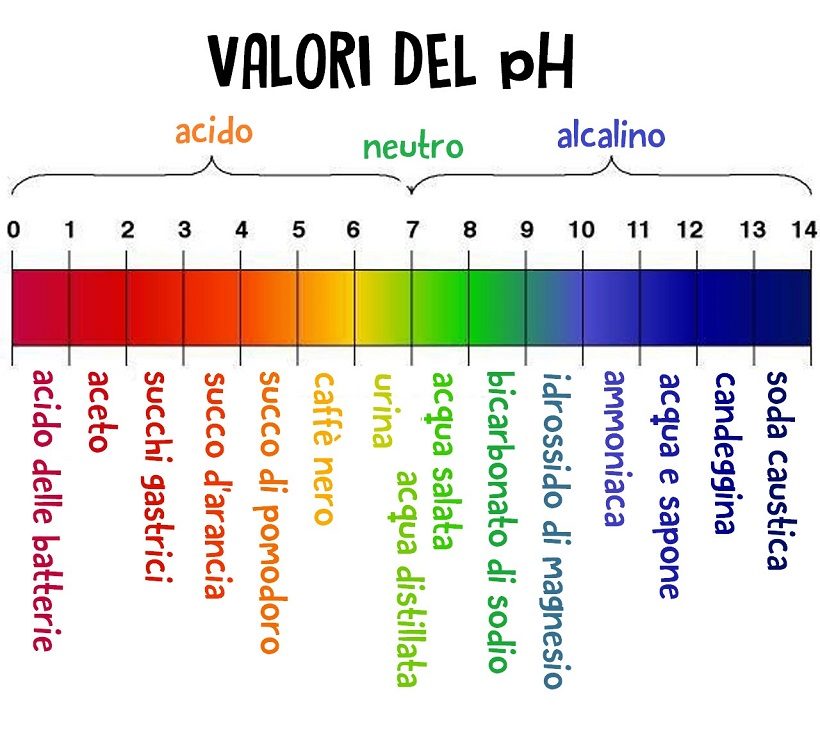
Convenzionalmente, il pH di soluzioni acquose assume valori compresi fra 0 (massima acidità) e 14 (massima basicità). Al valore intermedio di 7 corrisponde la condizione di neutralità, tipica dell’acqua pura a 25°C.
Il pH può essere misurato per via elettrica, sfruttando il potenziale creato dalla differenza di concentrazione di ioni idrogeno su due lati di una membrana di vetro (si veda piaccametro), o per via chimica, sfruttando la capacità di alcune sostanze (dette indicatori) di modificare il loro colore in funzione del pH dell’ambiente in cui si trovano. Normalmente, sono sostanze usate in soluzione, come per esempio la fenolftaleina e il blu di bromotimolo.
Molto spesso gli indicatori si usano anche supportati su strisce di carta (le cosiddette “cartine indicatrici universali”), le quali cambiano colore quando vengono immerse in sostanze acide o basiche. L’esempio più comune è quello delle “cartine di tornasole”, di colore rosa in ambiente acido e azzurro in ambiente alcalino.
Il pH nel vino tiene conto dell’acidità reale dello stesso, cioè della vera forza acida, varia da 3,00 a 3,8, non ha un limite legale a livello UE, poiché varia con il vitigno, il clima, l’annata, ecc. e permette di conoscere se un vino è stabilizzato dal punto di vista dell’intensità del colore, microbiologico, che a valori di pH può essere causa di malattie e gravi alterazioni.
Si ha:
- Valori inferiori a 3: sono valori tipici dei climi freddi o di uve raccolte immature; biologicamente il vino è molto stabile.
- Valori tra 3 e 3,4: valori normali dei vini bianchi.
- Valori tra 3,2 3 3,6: valori normali dei vini rossi.
- Valori superiori a 3,6: sono valori tipici dei climi caldi, di uve raccolte in sovra maturazione o di vini che hanno subito la fermentazione malolattica.
http://italiaxlascienza.it/main/2013/12/cancro-acidosi-e-dieta-alcalina/ph/
Cosa serve e come si misura il pH del vino
- Piaccametro o pH-metro è uno strumento che misura i valori di pH per via elettrica, sfruttando il potenziale creato dalla differenza di concentrazione di ioni idrogeno su due lati di una membrana di vetro. Un pH-metro trova applicazione in moltissimi settori tra cui: laboratorio, trattamento delle acque, controlli ambientali, piscine, potabilizzazione, acquacoltura e acquari, agricoltura, enologia, produzione e conservazione alimentare, industria di processo (cartiere, tipografie, galvaniche, tessile). Ogni modello è dotato di un elettrodo pH, progettato e realizzato per massimizzare performance e accuratezza per quello specifico campione/applicazione.

Piaccametro o pH-metro (foto http://www.azmeters.it/phmetro-c-60/)
- Agitatore magnetico: serve per mescolare il liquido da analizzare senza introdurvi strumenti esterni

Agitatore magnetico (foto http://svel.to/1723)
- 2 becher da 100 ml e una spruzzetta con acqua distillata per pulire elettrodi e sonda per la temperatura.

- Reattivi chimici: soluzione tampone a pH 4 e pH 7, per taratura pH-metro.
Bibliografia
- Giuseppe Carceri de Prati – Vita in Campagna n.1\2013
- Igino Santoni – Guida alle esercitazioni di laboratorio chimico-agrario Edagricole -1982
- Igino Santoni – Manuale di industrie agrarie – Edagricole 1980
- Wikipedia- Concetto pH
Gennaro Pisciotta, laureato in Scienze e Tecnologie agrarie all’Università G. Marconi – Facoltà di Scienze e Tecnologie Applicate di Roma, è Agrotecnico e Maestro Assaggiatore ONAF (Organizzazione Nazionale Assaggiatori Formaggio). Insegna presso l’ISIS “Falcone” di Pozzuoli (Napoli). Curriculum vitae >>>









