di Thomas Vatrano
I funghi terricoli sono importanti agenti di decomposizione, patogenicità e influenzano la salute del suolo e delle piante. Nei terreni agrari esistono almeno 25.000 specie fungine (Carlile and Watkinson, 1996a), rappresentando circa il 70% della biomassa microbica (Paul and Clark, 1996). La crescita dei funghi è in relazione alla disponibilità di carbonio. Molti organismi fungini sono stati trovati nella rizosfera, la quale è arricchita in carbonio organico derivante da proteine, amminoacidi, acidi organici e zuccheri rilasciati dalle radici; il mucopolisaccaride “mucigel” sulle radici. I gruppi più importanti di funghi tellurici nell’agroecosistema sono: saprofiti, patogeni e mutualistici. I funghi micorrizzici arbuscolari mutualistici sono i costituenti maggiori della biomassa fungina (Olsson et al., 1999; Veira et al., 2000) e sono stati studiati per alcune connessioni con la glomalina (GL), una glicoproteina contenente ferro, che copre le ife delle micorrizze arbuscolari. La GL potrebbe agire come una idrofobina (una proteina ricca di cisterna, espressa solo da funghi filamentosi), una classe di biomolecole che protegge le ife dalla perdita di nutrienti (Wessels, 1997), forma e stabilizza gli
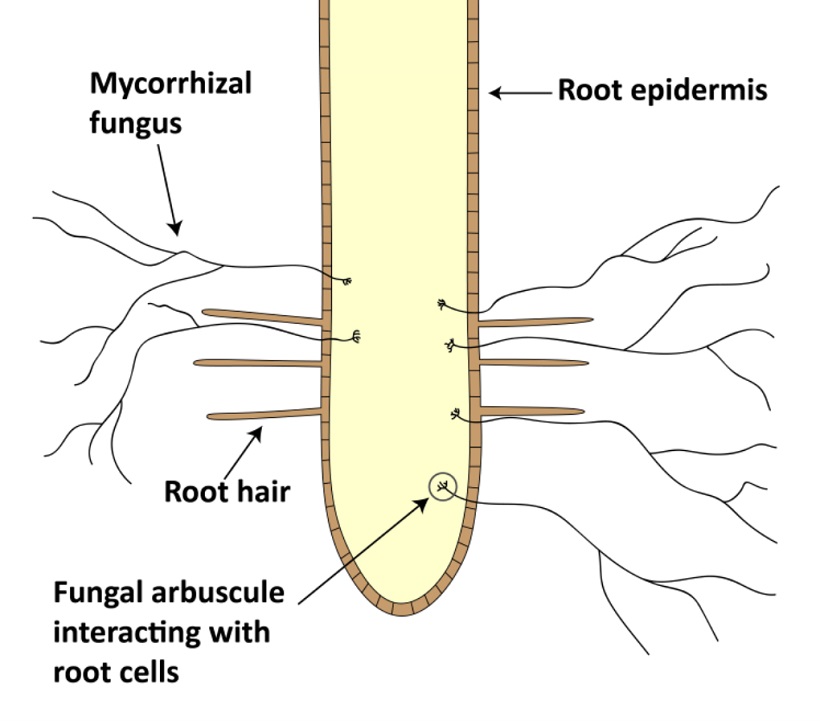
Meccanismo di azione di funghi micorrizzici arbuscolari (AMF) (tratto da http://www.seminis-us.com)
aggregati del suolo (Wright and Upadhyaya, 1998), e ne stocca il carbonio (Rillig et al., 2001b).
Le associazioni tra piante e micorrizze arbuscolari è una delle più importanti simbiosi sulla terra, collegando le radici e il sistema suolo (Koide and Mosse 2004), nonché la più antica e abbondante associazione pianta-microbi sulla terra (Smith and Read 1997). I funghi micorrizzici arbuscolari appartengono al phylum Glomeromycota e a quello dei Glomales (Schubler 2001).
Nelle relazioni mutualistiche, sia la pianta ospite che il fungo invasore traggono benefici. I funghi sono limitati sul carbonio e formano associazioni con le piante per acquisire il carbonio ottenuto con la fotosintesi. La biomassa delle piante ospiti aumenta visto il basso costo per l’acquisizione dei nutrienti, specialmente per quelli altamente immobili come il fosforo e lo zinco. Una migliore nutrizione può aumentare la resistenza alla siccità e alle malattie (Bolan, 1991; Hooker and Black, 1995; Paul and Clark, 1996).
Dei quattro principali tipi di funghi micorrizzici (orchidaceae, ericoide, ectomicorrizze, endomicorrizze), le endomicorrizze sono i funghi più abbondanti e ubiquitari negli agroecosistemi (Millner and Wright, 2002; Olsson et al., 1999). Le ife di questi funghi possono colonizzare più dell’80% delle radici nelle piante ospiti (Millner and Wright, 2002), penetrando la parete cellulare e formando delle strutture ramificate, chiamate arbuscoli, dove vengono scambiati i nutrienti e il carbonio. La colonizzazione intraradicale include le ife, spore, arbuscoli e vescicole (strutture di stoccaggio).
Circa il 12-30% del carbonio fotosintetizzato è traslocato nella forma di zuccheri che supporta la crescita e lo sviluppo fungino (Paul and Clark, 1996; Tinker et al., 1994). Questi zuccheri sono rapidamente convertiti in alcol per mantenere il flusso di carbonio ai funghi (Tinker et al., 1994).
Il costo del carbonio per la pianta è bilanciato attraverso l’accesso ad un grande volume di terreno attraverso le ife fungine. Le ife hanno un rapporto area/volume molto più ampio di quanto non facciano i peli radicali e si espandono fino a 8 cm aldilà della zona di diminuzione dei nutrienti attorno alle radici.
Questo permette ai funghi micorrizzici arbuscolari di cercare nutrienti altamente immobili come i fosfati. L’alto dispendio di carbonio per l’assorbimento del fosforo è compensato dall’aumento nella capacità fotosintetica dell’ospite in virtù dell’aumentata superficie fogliare ed efficienza fotosintetica (Bolan et al., 1991; George et al., 1992). Le micorrizze sono il meccanismo più efficace per l’acquisizione del fosforo, specialmente in condizioni di stress.
Riprendendo il concetto della glomalina, la sua importanza è legata all’aggregazione del suolo.
La GL si pensava fosse essudata dai funghi (Wright and Upadhyaya 1996), fino a quando Driver et al. (2005) scoprirono che la GL era solo rilasciata dai funghi micorrizzici arbuscolari (AMF) durante il turnover ifale e dopo la morte del fungo. La GL, sebbene non sia ancora stata definita biochimicamente, è una glicoproteina collegata all’azoto composta dal 3 al 5% di N, dal 36 al 59% di C (Lovelock et al. 2004; Schindler et al. 2007), dal 4 al 6% da idrogeno, dal 33 al 49% da ossigeno e dallo 0,03 allo 0,1% da P (Schindler et al. 2007).
E’ un composto stabile, insolubile in acqua e resistente alla degradazione termica (Wright et al. 1996).
E’ stata trovata in terreni agricoli, forestali, desertici e non coltivati (Wright and Upadhyaya 1996; Rillig et al. 2003a; Nichols and Wright 2004; Antibus et al. 2006; Bai et al. 2009).
Diversi autori hanno trovato diverse concentrazioni di GL, anche se la maggior parte dei quantitativi si trovano nell’orizzonte A del suolo, anche gli orizzonti B e C ne contengono (Rillig et al. 2003a) e si può anche trovare fino alla profondità di 140 cm nel profilo del suolo (Harner et al.2004).
Gli effetti a lungo termine di AMF sull’aggregazione del suolo possono essere attribuiti alla produzione di GL attraverso i funghi (Rillig 2004a, b; Rillig and Mummey 2006).
Wright e Anderson (2000) trovarono una positiva correlazione tra la GPRS (proteine del suolo correlate alla glomalina), la frazione totale della glomalina nel suolo, e la stabilità degli aggregati del suolo all’acqua attraverso una varietà di suoli sotto differenti sistemi di coltivazione e pratiche colturali.
Dato che l’aggregazione del suolo gestisce l’acqua, il contenuto di nutrienti e gli scambi gassosi, la GL potrebbe svolgere un ruolo cruciale nell’areazione del suolo e drenaggio, l’assorbimento dei nutrienti nelle piante e la produttività (Nichols and Wright 2004). La colonizzazione fungina, la densità delle spore e la glomalina hanno un distinto schema di distribuzione spaziale, che è influenzato dai fattori del suolo. L’ureasi, la disponibilità di N e il carbonio organico sono i principali fattori tellurici che influenzano la distribuzione degli AMF e pertanto della glomalina. In virtù di tutto ciò, lo schema di distribuzione di AMF e GL potrebbe essere usato per monitorare la desertificazione e la degradazione del suolo.
La GL facilita lo stoccaggio del C nel suolo (Zhu and Miller 2003; Rillig 2004b). Rillig et al. (2011) trovarono che la GL appresenta il 4-5% dell’azoto e carbonio totale in suoli Hawaiani e hanno riportato che il contributo delle glicoproteine verso il C totale era più grande rispetto alla biomassa di C microbico.
La GL è stata associata anche con la proteina 60 da shock termico (hsp60), facente parte di un gruppo di proteine prodotte cellule eucariotiche e procariotiche quando stressate da condizioni ambientali, come aumento termico, variazioni di pH e inedia (Gadkar and Rillig 2006; Purin and Rillig 2007).
Gadkar and Rillig (2006), hanno dimostrato che le sequenze di amminoacidi della glomalina sono correlate all’hps60, perciò hanno confermato che la GL potrebbe avere una funzione protettiva per AMF, come già affermato da Rilling and Steinberg (2002); Driver et al. (2005).
A causa delle intensificazioni delle coltivazioni, il settore dell’agricoltura è diventato uno dei maggiori fattori di incidenza sul riscaldamento globale (Janzen 2004).
Considerato che le emissioni di CO2 provenienti dal suolo sono principalmente dovute alla errata gestione delle pratiche colturali che distruggono la struttura del suolo, alcune pratiche che promuovono la formazione di aggregati e la stabilizzazione ridurranno le perdite di C dal suolo. E’ interessante sapere che i benefici effetti derivanti dalla minima lavorazione sulla struttura del suolo sono stati correlati ad alte concentrazione di GL in suoli glomerulari (Wright and Upadhyaya 1998; Wright and Anderson 2000).
L’alta quantità di ife prodotte da AMF è correlata con un significativo aumento nella stabilità aggregativa dei suoli, la capacità degli stessi a trattenere i nutrienti, il contenuto di acqua, cosi come la penetrazione delle radici nel suolo e la potenziale erosione (Treseder and Turner 2007).
A tal proposito, la stretta connessione micorrizzica può creare indefinite ulteriori reti di connessione tra le piante e tali formazioni di AMF potrebbero essere un importante elemento nella riduzione dei gas serra (Kumar Singh P et al., 2013).
Nel lavoro di Sharifi Z. et al. (2018), dove è stata valutata la risposta delle GPRS alle lavorazioni del terreno e al passaggio del fuoco nelle foreste è emerso che il carbonio organico totale (TOC) e la glomalina nella zona non esplorata dalle radici erano più bassi in vigneti rispetto alle foreste non colpite da incendi, mentre il fuoco non ha cambiato il contenuto di TOC ma ha aumentato il contenuto di GL con l’aumento della gravità dell’incendio. In confronto alla foresta non incendiata, la GL e il TOC nella foresta bruciata e nel vigneto erano proporzionalmente aumentato negli aggregati più piccoli a discapito di quelli più grandi. La GL era positivamente correlata con il TOC, e entrambi positivamente correlati con l’indice di stabilità degli aggregati, facendo risaltare l’importanza di questi due componenti del suolo sulla formazione della struttura dello stesso.
Il contributo della GL al TOC del suolo nel vigneto e le porzioni di suolo della foresta coinvolte da un’alta violenza del fuoco era significativamente più alte rispetto a quella del suolo nella foresta non incendiata, perciò viene suggerito il rapporto come un indicatore della degradazione del suolo in virtù delle classiche lavorazione e del fuoco.
Bibliografia
- Antibus RK, Lauber C, Sinsabaugh RL, Zak DR (2006) Responses of Bradford-reactive soil protein to experimental nitrogen addition in three forest communities in northern lower Michigan. Plant Soil 288:173–
- Bai C, He X, Tang H, Shan B, Zhao L (2009) Spatial distribution of arbuscular mycorrhizal fungi, glomalin and soil enzymes under the canopy of Astragalus adsurgens in the Mu Us sandland, China. Soil Biol Biochem 41:941–947.
- Carlile M.J. and Watkinson S.C., 1996a. Saprotrophs and ecosystems. In M.J. Carlile and S.C. Watkinson (eds.), The Fungi. Academic Press, New York, chap. 6.
- Driver JD, Holben WE, Rillig MC (2005) Characterization of glomalin as a hyphal wall component of arbuscular mycorrhizal fungi. Soil Biol Biochem 37:101–106
- Gadkar V, Rillig MC (2006) The arbuscular mycorrhizal fungal protein glomalin is a putative homolog of heat shock protein 60. FEMS Microbiol Lett 263:93–
- Harner MJ, Ramsey PW, Rillig MC (2004) Protein accumulation and distribution in floodplain soils and river foam. Ecol Lett 7:829–
- Janzen HH (2004) Carbon cycling in earth systems—a soil science Agric Ecosysts Environ 104:399–417
- Koide RT, Mosse B (2004) A history of research on arbuscular mycorrhiza. Mycorrhiza 14:145–163.
- Kumar Singh P., Singh M., Tripathi B. N. 2013. Glomalin: an arbuscular mycorrhizal fungal soil protein – Protoplasma 250:663–DOI 10.1007/s00709-012-0453-z.
- Lovelock CE, Wright SF, Clark DA, Ruess RW (2004) Soil stocks of glomalin produced by arbuscular mycorrhizal fungi across a tropical rain forest landscape. J Ecol 92:278–
- Nichols KA, Wright SF (2004) Contributions of fungi to soil organic matter in agroecosystems. In:Magdoff F,Weil RR (eds) Soil organic matter in sustainable agriculture. CRC, Florida, pp 179–
- Olsson P.A., Thingstrup I., Jakobsen and Baath E. 1999. Estimation of the biomass of arbuscular mycorrhizal fungi in linseed field. Soil Biol. Biochem. 31 (13): 1879-1887.
- Paul E.A., and Clark F.E. 1996. Soil Microbiology and biochemistry, 2nd Academic Press, New York. Pawlowska, t.E., R. L. Chaney M. Chin, and I. Charvat. 2000. Effects of metal phytoextraction practices on the indigenous community of arbuscular mycorrhizal fungi at a metal-contaminated Iandfill. Appl. Environ. Microbiol. 66 (6): 2526-2530.
- Purin S, Rillig MC (2007) The arbuscular mycorrhizal fungal protein glomalin: limitations, progress, and a new hypothesis for its Pedobiologia 51:123–130.
- Rillig MC, Wright SF, Nichols KA, Schmidt WF, Torn MS (2001) Large contribution of arbuscular mycorrhizal fungi to soil carbon pools in tropical forest soils. Plant Soil 233:167–177
- Rillig MC, Ramsey PW, Morris S, Paul EA (2003a) Glomalin, an arbuscular-mycorrhizal fungal soil protein, responds to land-use Plant Soil 253:293–299.
- Rillig MC (2004a) Arbuscular mycorrhizae and terrestrial ecosystem Ecol Lett 7:740–754.
- Rillig MC (2004b) Arbuscular mycorrhizae, glomalin, and soil aggregation. Can J Soil Sci 84:355–
- Rillig MC, Mummey DL (2006) Mycorrhizas and soil structure. New Phytol 171:41–53
- Schindler FV, Mercer ER, Rice JA (2007) Chemical characteristics of glomalin-related soil protein (GRSP) extracted from soils of varying organic matter content. Soil Biol Biochem 39:320–
- Schubler A (2001) Molecular phylogeny, taxonomy, and evolution of Geosiphon pyriformis and arbuscular mycorrhizal fungi. Plant Soil 244:75–
- Sharifi Z., Azadi N., Rahimi S., Certini G. 2018. The response of glomalin-related soil proteins to fire or tillage – Geoderma 329 65–72. https://doi.org/10.1016/j.geoderma.2018.05.008
- Smith SE, Read DJ (1997) Mycorrhizal symbiosis, 2nd edn. Academic, New York.
- Treseder KK, Turner KM (2007) Glomalin in ecosystems. Soil Sci Soc Am J 71:1257–
- Veira R.F., Silva C.M.M.S., Maia A.H.N., Fay E.F. and Coelho K.C. 2000. An appraisal of five methods for the measurement of the fungal population in soil treated with chlorothalonil. Pest Manage. Sci. 56: 431-440.
- Wessels J.G.H. 1997. Hydrophobins: Proteins that change the nature of the fungal surface. Microb. Physiol. 38: 1-45.
- Wright SF, Upadhyaya A (1996) Extraction of an abundant and unusual protein from soil and comparison with hyphal protein from arbuscular mycorrhizal fungi. Soil Sci 161:575–586.
- Wright SF, Franke-Synder M, Morton JB, Upadhyaya A (1996) Timecourse study and partial characterization of a protein on hyphae of arbuscular mycorrhizal fungi during active colonization of roots. Plant Soil 181:193–
- Wright SF, Upadhyaya A (1998) A survey of soils for aggregate stability and glomalin, a glycoprotein produced by hyphae of arbuscular mycorrhizal fungi. Plant Soil 198:97–107
- Wright SF, Anderson RL (2000) Aggregate stability and glomalin in alternative crop rotations for the central Great Plains. Biol Fert Soils 31:249–
- Zhu Y, Miller RM (2003) Carbon cycling by arbuscular mycorrhizal fungi in soil–plant systems. Trends Plant Sci 8:407–409
Thomas Vatrano – Laureato in Scienze e Tecnologie Agrarie nel 2007 presso l’Università degli studi Mediterranea di Reggio Calabria. Conseguito il titolo di Dottore di Ricerca, in Scienze Farmaceutiche, presso l’Università degli studi Magna Graecia di Catanzaro – A.A. 2014-15. Durante il Dottorato di Ricerca si è specializzato nell’identificazione varietale in olivo e la rintracciabilità molecolare dell’olio d’oliva attraverso l’utilizzo di marcatori molecolari SSR. Ha collaborato con il Consiglio per la Ricerca in Agricoltura e l’Analisi dell’Economia Agraria (CREA) Centro di Ricerca per l’Olivicoltura, Frutticoltura e Agrumicoltura (CREA-OFA), dove si è occupato di sperimentazione di portinnesti nanizzanti da adattare al sistema di allevamento superintensivo. Attualmente svolge l’attività di consulente tecnico per conto di Organazoto fertilizzanti SpA. E-mail: thomasvatrano@gmail.com








