Riflessioni sulla risposta immunitaria sistemica delle piante (Seconda Parte)
di Umberto Mazzucchi
Prima Parte
- Il segnale induttore
- La necrosi ipersensitiva come sorgente di segnali
- Il calcio segnale ubiquitario per la risposta delle piante agli stress
Seconda Parte
- Un modello di segnalazione per l’induzione della SAR
- Accettabilità del modello
Lavori citati
Glossario

Maculature da Xanthomonas campestris pv. pruni su susine
Un modello di segnalazione per l’induzione della SAR.
Nel modello di segnalazione proposto per l’induzione della SAR si può ammettere che cellule soggette alla infezione d’innesco (cellule d’innesco), sia normosensitive che ipersensitive, liberino ROS e DAMP captati da cellule limitrofe vive e sensibilizzate (cellule d’avvio) del tessuto sano, dove si genererà il segnale sistemico trasmesso a distanza (Fig. 3) È possibile che ROS e glutammato (o altro amminoacido?) (21) possano avviare la trasmissione (27). La H2O2 dei ROS generati da cellule danneggiate o moribonde a seguito della infezione d’innesco può entrare via pori di aquaporina (19) nelle cellule d’avvio e stimolare apertura di canalicoli del calcio (es. GLR) causando iniziale aumento di concentrazione di Ca2+nel loro citosol; alternativamente o contemporaneamente nelle cellule d’avvio la H2O2 può essere riconosciuta dal recettore HPCA1 del plasmalemma (2,12,33) che, per propria attività chinasica o attivando la chinasi RLCK, può aprire loro canalicoli del calcio (Fig.4); altra possibilità è che la H2O2 possa penetrare via endocitosi (19). Parimenti DAMP trasmessi da cellule d’innesco sarebbero riconosciuti da canalicoli GLR del plasmalemma di cellule d’avvio causando loro apertura e flusso di Ca2+da apoplasto a citosol (27).
Questo iniziale aumento di concentrazione di Ca2+ nel citoplasma delle cellule d’avvio stimolerebbe ulteriore apertura di loro numerosi canalicoli del calcio sia nel plasmalemma che in altri comparti (particolarmente reticolo endoplasmatico e i CTP1 del vacuolo) contribuendo ad elevarne sensibilmente la concentrazione. Le cellule d’avvio diverrebbero progressivamente depolarizzate fino a raggiungere una soglia critica di potenziale (picco). Al raggiungimento del picco inizierebbe la loro ripolarizzazione con declino progressivo del potenziale fino a ritornare alla situazione iniziale di equilibrio, salvo un brevissimo periodo “refrattario” poco al di sotto del suo valore (9) (Fig.2, A e B). La ripolarizzazione sarebbe indotta dalla fuoriuscita di ioni di appropriata carica attraverso il plasmalemma per ricreare il potenziale di equilibrio. Il picco di potenziale della cellula d’avvio depolarizzata, espressione di potenziale di azione AP (acronimo di Action Potential), si propagherebbe “passivamente” lungo i plasmalemmi del simplasto, cellula dopo cellula (con velocità da 0,5-4mm/s fino a 10-30 mm/s) e rappresenterebbe la componente elettrica di trasmissione del segnale per la risposta sistemica (Fig.3). Alla ripolarizzazione di ogni cellula e al controllo della propria omeostasi del Ca2+ contribuirebbe l’entrata in attività di pompe Ca-ATPasi, trasferenti a spese di ATP il calcio fuori dal citosol (o dentro agli organuli o in apoplasto); alcune ATPasi trasferendo protoni (H+) dal citosol all’apoplasto creerebbero un ambiente meno alcalino contrastante l’apertura dei canalicoli del calcio nel plasmalemma (13).
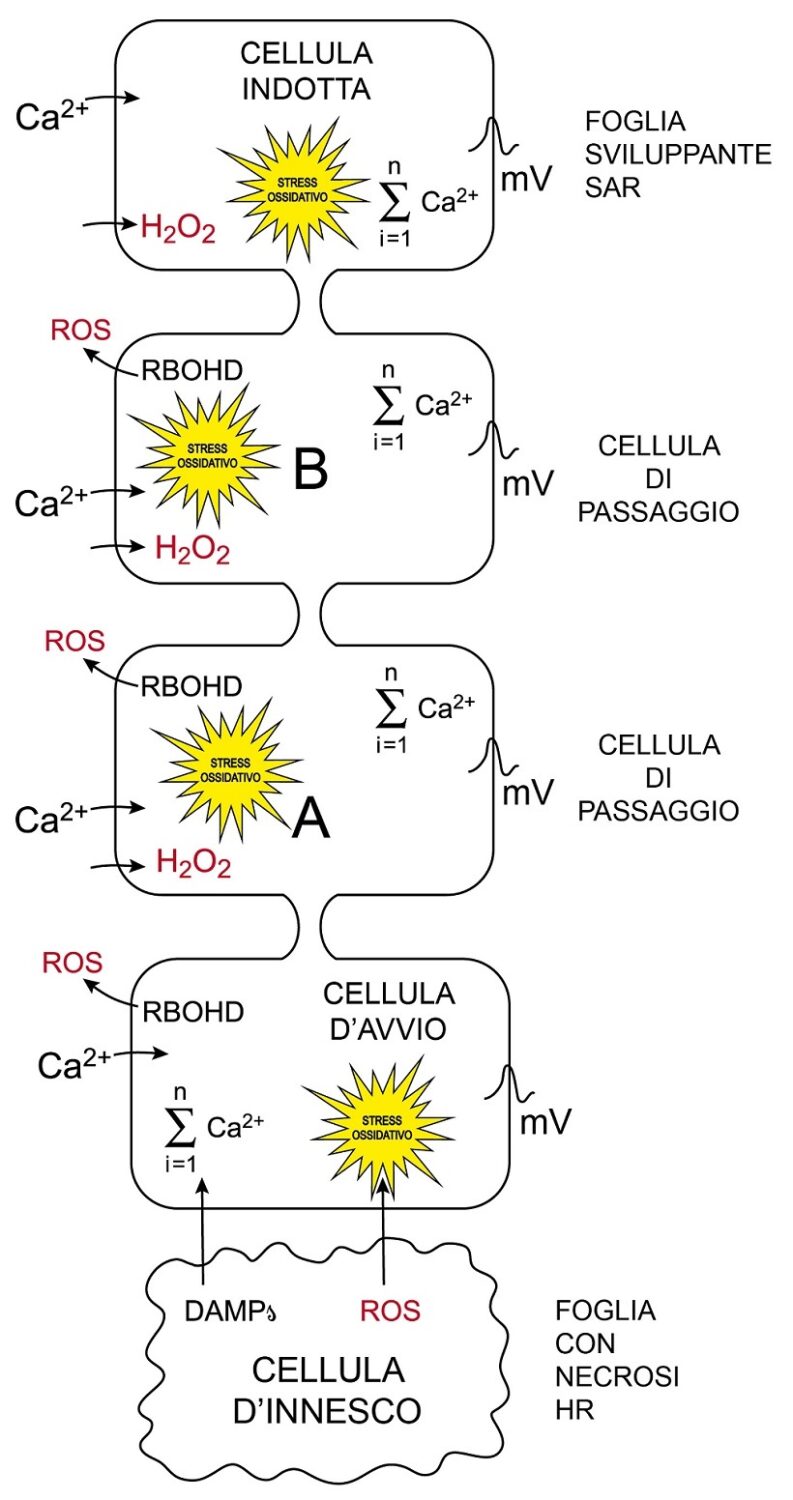
Fig.3 – Modello di trasmissione del segnale di induzione della SAR
Modello didattico di trasmissione del segnale composito inducente a distanza la SAR. Le cellule sono disegnate senza parete, contornate dal solo plasmalemma. Nella foglia basale con maculatura ipersensitiva, cellule d’innesco moribonde per effetto della HR liberano DAMPs e ROS accolti da cellule sane sensibilizzate limitrofe che diventano cellule d’avvio del segnale per la SAR. Nelle cellule d’avvio per effetto sia dei DAMPs (es. amminoacidi) che della H2O2 (componente più stabile e mobile dei ROS) si aprono via via canalicoli del Ca2+ del plasmalemma e di altri comparti, del vacuolo in particolare. Nelle cellule d’avvio si ha progressivo aumento di concentrazione di Ca2+nel citosol fino ad un picco di potenziale del plasmalemma tale da depolarizzarle. Iniziando la ripolarizzazione, il picco si estende alle limitrofe zone di plasmalemma non eccitate e prosegue via via di cellula in cellula, lungo i plasmalemmi, sino a coinvolgere i tubi cribrosi e seguire percorso acropeto. Nella cellula di avvio, la RBOHD, attivata dal Ca2+trasferisce elettroni all’ossigeno in apoplasto producendo anione superossido da cui, per riduzione, si genera H2O2. La H2O2 via aquaporina penetrerà nella cellula successiva causando stress ossidativo o ossiderà il recettore HPCA1 avviando la sua attività chinasica.; un canalicolo contiguo del Ca2+fosforilato, aprendosi, fa passare lo ione da apoplasto a citoplasma. Analogamente alla cellula di avvio, la cellula A per effetto dello stress ossidativo e dell’incremento di concentrazione di Ca2+ nel citoplasma stimolerà la successiva cellula B e così via di cellula in cellula fino alle cellule della foglia dove si svilupperà la SAR. Passate le onde ossidative e di Ca2+, le cellule cercheranno di riprendere il controllo della propria omeostasi con appropriati strumenti, pur assumendo un peculiare stato di sensibilizzazione metabolica assimilabile ad una impronta lasciata dal passaggio del segnale. L’incremento di concentrazione di Ca2+ nel citosol è indicato con il simbolo di sommatoria per evidenziare il contributo di numerosi canalicoli con sede in membrane di comparti differenti oltre al plasmalemma.
Nelle cellule di avvio il calcio con legame diretto alla proteina o per mezzo di fosfochinasi (es. fosforilazioni alle estremità citosoliche N e C) attiverebbe la RBOHD (meno importante la RBOHF, per la risposta immunitaria), NADPH ossidasi associata al plasmalemma (es. Rivista di Agraria 362, Fig.1) che trasferendo un elettrone per volta da NADPH all’ossigeno produce anione superossido (O2.- ), tappa iniziale di una serie di reazioni culminanti in accumulo locale di ROS in apoplasto, a ridosso della parete, condizionato dalla presenza attiva di superossido dismutasi (SOD) e di perossidasi (PRX) (18,19 ) (Fig. 4, A).Le SOD ridurrebbero l’anione superossido ad acqua ossigenata (H2O2), le PRX la ridurrebbero ad H2O.L’acqua ossigenata è il composto più stabile e mobile dei ROS. La H2O2 generata in apoplasto diffonderebbe nei pori di parete lungo il plasmalemma fino alla cellula successiva (Fig. 4,B), dove penetrando via pori di aquaporina del plasmalemma o ossidando il recettore HPCA1 causerebbe stress ossidativo, accumulo di calcio nel citosol e attiverebbe la RBOHD, analogamente a quanto descritto poc’anzi per la H2O2 prodotta dalle cellule d’innesco. Questa attivazione di RBOHD associata ad abnorme stress ossidativo cellulare e alla prominente concentrazione di Ca2+nel citosol si propagherebbe di cellula in cellula dando luogo a stress concatenati sino a coinvolgere cellule dell’organo indotto (4,9,19) (Fig.3).
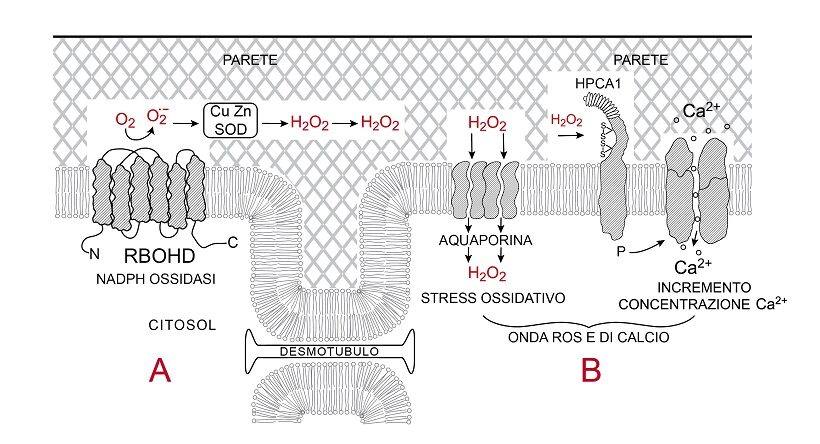
Fig.4 – Entrata della onda ROS in una cellula (B)
Presentazione schematica della generazione di stress ossidativo e aumento di concentrazione di Ca2+ nel citosol di una cellula B, conseguenza della attività della NADPH ossidasi RBOHD associata al plasmalemma della cellula vicina A; il tratto di parete centrale mette in luce la comunicazione dei citoplasmi tra cellula e cellula via ristretta manica citosolica attorno al desmotubulo. La RBOHD della cellula A trasferisce elettroni all’ossigeno in apoplasto generando anione superossido (O2.-), che è ridotto a varie forme reattive dell’ossigeno (19), tra cui acqua ossigenata (H2O2) per azione di superossido dismutasi (SOD) presenti in apoplasto. H2O2 può muoversi nei pori della parete a ridosso del plasmalemma e poi penetrare nella cellula B attraverso i pori dell’aquaporina, presentata come semitetrade, causando stress ossidativo nel suo citoplasma oppure ossidare coppie di gruppi solfidrilici (-SH) di cisteine del dominio apoplastico del suo recettore HPCA1 che, attivando proprio dominio chinasico citoplasmatico (P), fosforila un vicino canalicolo del Ca+. Il canalicolo si apre e il Ca2+ dall’apoplasto passa al citosol della cellula B per gradiente favorevole di concentrazione.
Nella cellula B lo stress ossidativo induce apertura di numerosi canalicoli del Ca2. L’elevata concentrazione citosolica attiva le RBOHD della cellula B. Il ciclo si ripete per la cellula successiva del percorso del segnale e così via.
Oltre al plasmalemma a contatto con la parete, RBOHD, aquaporine e recettore NPCA1 sono associati anche a membrane degli organuli citoplasmatici (es. cloroplasti, mitocondri, perossisomi) e al plasmalemma presso l’imboccatura dei plasmodesmi. Si ammette pertanto che il trasferimento della H2O2 dai punti di produzione abbia luogo non solo coinvolgendo apoplasto e parete (come descritto poc’anzi; Fig.3), ma anche tra organulo e organulo (19) e possibilmente lungo la manica citosolica dei plasmodesmi [spazi ai lati del desmotubulo; Ø 1,5-3.0 nm] (Fig.4, A-B), sebbene in presenza di ROS tendano ad occludersi. In ogni cellula al momento dello stress ossidativo la H2O2 altera gli stati redox di citosol e nucleo e modifica la espressione genica a seguito o meno di variazione di stato di fattori di trascrizione (23).
In ogni cellula, tuttavia, la omeostasi dei ROS è strettamente controllata ad evitare ossidazioni irreversibili di proteine (18). Diviene pertanto essenziale per ogni cellula rimuovere adeguatamente i ROS dal proprio citosol con interventi mirati usando enzimi e molecole antiossidanti (19); l’attività di RBOHD, ad esempio, tempestiva e temporanea per la segnalazione, viene regolata positivamente, come si è visto, per mezzo di fosforilazioni in domini delle estremità N e C citoplasmatiche (da chinasi BIK1, SIK1, CIPK; CRK2), negativamente mediante ubiquitinazione sulla estremità C citoplasmatica e successiva distruzione in vacuolo (15). Al passaggio del segnale ogni cellula viene a trovarsi in uno stato di produzione, eliminazione e trasporto di ROS. È questo stato temporaneo di stress cellulare denominato “onda ROS” che si autopropaga di cellula in cellula (6,19), lasciando -come si è visto- una sorta di “impronta fenotipica” del suo passaggio (23).
Accettabilità del modello
Il calcio è pertanto l’interruttore della RBOHD avviante la serie di stress ossidativi concatenati coinvolgenti cellula dopo cellula, dalla cellula di avvio fino ai tessuti dell’organo indotto, dove si manifesterà la SAR (Fig.3). Secondo il modello illustrato, il segnale sistemico inducente la SAR sarebbe composito, dato anzitutto da onde contemporanee di stress ossidativi e incrementi temporanei abnormi citosolici di calcio, accompagnate dal segnale elettrico del movimento di AP lungo i plasmalemmi. A differenza della segnalazione sistemica a seguito di ferite, per la SAR mancherebbe la componente idraulica per assenza della cavitazione e aumento di turgore delle cellule aderenti allo xilema, indotte dai vasi recisi (6); d’altra parte per assenza di ferita e introduzione di certi cationi, si può escludere abbiano luogo SP (acronimo di System Potential) (36).Mentre tutti concordano circa l’insorgenza degli AP nelle piante a seguito di stress, ci sono opinioni discordi circa il loro ruolo nella segnalazione “a grande distanza” all’interno della pianta, particolarmente per l’inefficiente connessione tra tubi cribrosi e cellule limitrofe per la propagazione del segnale elettrico. Il loro ruolo si esaurirebbe a breve distanza nell’organo dove sono stati generati (26). È pur vero che la sperimentazione sulla trasmissione a distanza dei segnali vien fatta comunemente su piante di piccole dimensioni, per lo più di A. thaliana. Se l’incremento di concentrazione di Ca2+nel citoplasma di ogni cellula al momento dell’onda ROS genera ogni volta un picco depolarizzante, il movimento di AP ovvero del segnale elettrico lungo i plasmalemmi da una cellula all’altra diviene perfettamente sincrono al passaggio delle onde ROS e Ca2+.
Nella foglia d’innesco di A. thaliana l’accumulo di H2O2 nelle cellule dei tessuti distanti dalla area ipersensibile si ha già dopo 2-3 ore dalla inoculazione del batterio incompatibile; nella foglia distante, dove svilupperà la SAR, l’accumulo di H2O2 si ha già dopo 3-4 ore (1). Ciò indica che uno stato di stress ossidativo si sia propagato dapprima nelle cellule normosensitive attorno all’area ipersensibile (cellule d’avvio) e poi a cellule di altri tessuti fino a quelle della foglia distale dove ha avuto luogo la SAR; d’altra parte si sa che dopo 4 ore dalla inoculazione del batterio incompatibile scatenante il collasso della infezione d’innesco i tessuti della foglia distale hanno già ricevuto il segnale e trascrizioni di geni di difesa riferibili alla futura SAR sono già in corso (28). Evidentemente un modello di segnalazione basato su onde ROS consecutive e concatenate,associate ad incrementi citosolici di Ca2+,può soddisfare pienamente la tempistica della trasmissione e la natura di mero segnale.
Non si può escludere che in qualche caso lungo il percorso possano aver luogo “incidenti di trasmissione” connessi alla ripetitiva induzione di stress ossidativo nelle cellule di passaggio, particolarmente se esposte a situazioni più a rischio (1). Di fatto microlesioni necrotiche ipersensibili (microHR) coinvolgenti cellule in prossimità delle nervature sono state osservate in foglie superiori di Arabidopsis solo nei casi di infezione d’innesco ipersensibili da patogeno avirulento nella foglia inferiore. È verosimile, tuttavia, che queste microHR intermedie al percorso possano aver potenziato il segnale per la SAR nelle foglie indotte (4,6,9,19).
Fenomeno analogo alla SAR indotto nelle piante dalla presenza di microrganismi naturali o applicati, viventi associati alle radici o in generale endofiti, è stato denominato Resistenza Sistemica Indotta (ISR ; acronimo di Induced Systemic Resistance) (29). Sia SAR che ISR mettono in luce la possibilità di lotta alle malattie delle piante per mezzo di vaccinazioni. Osservazioni pluriannuali indicano che vaccinazioni naturali e le loro ripercussioni epigenetiche possano aver luogo sia in ambiente naturale che agrario, conferendo resistenza a malattie e condizionando la evoluzione di epidemie (24).
Lavori citati
1) Alvarez M.E. et al. ,1998. Cell 92,773-784.
2) Castro B. et al., 2021. Nature Plants 7,403-412.
3) Chester K.S. 1933. The Quarterly Review of Biology 8,129-154.
4) Fichman Y. et al. ,2019. Molecular Plants 12,1203-1210.
5) Forde B. e M.R. Roberts,2014. F1000Prime Reports 6 :37.
6) Gilroy S. et al.,2016. Plant Physiology 171,1606-1615.
7) Goodman R.N. e A.J. Novacky,1994. The hypersensitive reaction in plants to pathogens. 244pp. APS Press.
8) Hammerschmidt R.,2009. Systemic acquired resistance. In Advances in Botanical Research. Vol.51,174-222.
9) Johns S. et al. ,2021. Plant Physiology 185,694-706.
10) Kachroo A. e P. Kachroo, 2020.Current Opinion in Plant Biology 58,41-47.
11) Kim N.H. et al., 2022. New Phytologist 234,813-818.
12) Kong X. et al., 2020. Trends in Plant Science 25,9,838-841.
13) Köster P. et al.,2022. The EMBO Journal 41, e110741.
14) Kuc’ J.,1987. Annals New York Academy of Sciences,494,221-223.
15) Lee DH. et al., 2020.Nature Communications 11, 1838, 1-16.
16) Li J-H. et al.,2021. Journal of Plant Physiology 261,153418.
17) Liu Y.et al. ,2005. Cell 121,4,567-577.
18) Martin R.E. et al., 2022. Current Opinion in Plant Biology 69,102293.
19) Mittler R. et al. ,2022. Nature Reviews Molecular Cell Biology 23,663-679.
20) Mur L.A.J. et al., 2008. Journal of Experimental Botany 599,3,501-520.
21) Moorman J. et al.,2022. Trends in Biochemical Sciences 47,10,839-850.
22) Morales J. et al.,2016 Journal of Experimental Botany 67,1663-1676.
23) Noctor G. et al.,2018. Seminars in Cell & Development Biology 80,3-12.
24) Osler R.,2021. Le piante immunizzate. Ed.Forum, 183pp.
25) Pirayesh N. et al. ,2021. BBA Molecular Cell Research 1868,118948.
26) Robinson D.G. e A. Draguhn,2021. Journal of Plant Physiology 263, Art.15347.
27) Toyota M. et al., 2018. Science 361,1112-1115.
28) Truman W. et al.,2007. PNAS 104,3,1075-1080
29) Vlot A.C. et al., 2021.New Phytologist 229,1234-1250.
30) Volkov A.G. e D.R.A. Ranatunga2006. Plant Signals Behaviour 1, 3, 105-115.
31) Wang C. et al.,2019. Nature Communications 10,4810.
32) Wang R.et al., 2020.Trends in Plant Science 25,11,1060-1062.
33) Wu F.H. et al., 2020.Nature 578,577-581.
34) Zeier J.,2021. Current Opinion in Plant Biology 62, 102050.
35) Zhang H. et al.,2022. Nature Reviews Genetics 23,1104-1119.
36) Zimmerman C. et al.,2009. Plant Physiology 149,1593-1600.
Glossario
Non-Self: Una biomolecola o un organismo che la pianta percepisce essere di diversa origine o in condizione differente dal normale, riconosciuti durante la propria attività metabolica per conservare la omeostasi.
DAMP: Molecola proveniente da cellule danneggiate o moribonde (es. eATP, eNAD, amminoacidi, oligogalatturonidi etc.). É riconosciuta dalle cellule normali come “non self”.
Sistema immunitario innato: Capacità di percepire come segnale di pericolo il non sé (non-self) e il sé danneggiato o alterato (DAMP) e di rispondere, usufruendo di appropriati strumenti di sorveglianza.
Stress: Ogni fattore esterno, o variazione di condizione, capace di allontanare significativamente la pianta dalla sua massima produttività; può agire in senso favorevole o sfavorevole (Matta A. et al., 1986)
Stress biotico: Causato da fattori biologici (es. patogeni)
Stress abiotico: Causato da fattori non biologici, fisici (es. t°) o fisico-chimici (es. pH, molecole organiche)
Apoplasto: Nei tessuti vegetali, tutto ciò che rimane all’esterno della membrana citoplasmatica (o plasmalemma) delle cellule (pareti, spazi intercellulari, trachee, tracheidi).
Simplasto: Nei tessuti vegetali, tutto ciò che rimane all’interno della membrana citoplasmatica: l’insieme dei protoplasti, collegati tra loro dai plasmodesmi, inclusi quelli dei tubi cribrosi del floema.
Citosol: La componente liquida e non strutturata del citoplasma, in cui sono immersi gli organuli (cloroplasti, mitocondri, etc.) e il citoscheletro della cellula vegetale.
Plasmalemma: Sinonimo di membrana citoplasmatica. Nel testo per la struttura si fa riferimento alla teoria del mosaico fluido rivisitata (Nicolson G.L,2014; Gronnier et al.,2018).
Recettore : Struttura capace di reagire a stimoli dando luogo ad una reazione caratteristica.
Trasduzione : Una molecola segnale esterna attiva uno specifico recettore dentro o alla superficie della cellula. Questo recettore va ad attivare una via biochimica dentro la cellula, creando una risposta.
ROS : Forme reattive dell’ossigeno: anione superossido, acqua ossigenata, radicale idrossile, etc.( 19 )
ATP : Adenosina trifosfato; ADP: Adenosina difosfato;
NAD : Nicotamide adenina dinucleotide;
NO : Ossido di azoto;
HR : Reazione di ipersensibilità. Per una cellula comporta morte;
Ubiquitina : Piccola proteina che si lega singola o a catenella alle proteine “difettose” o “usurate” da distruggere. Le proteine marcate ovvero “ubiquitinate” sono avviate al proteasoma per essere distrutte;
Proteasoma : All’interno delle cellule, struttura cilindrica tubolare costituita da proteine che espongono nella cavità interna siti catalitici per la distruzione delle proteine. Le proteine marcate con ubiquitina entrano all’imbocco del “tubo” e percorrendo la cavità interna vengono via via degradate per rottura dei legami tra gli amminoacidi. Alla uscita, brevi catene di amminoacidi sono a disposizione della cellula;
Aquaporina: Piccola proteina a 6 eliche transmembrana con estremità C e N esposte al citosol, con poro centrale idrofilo; associate a tetrameri in plasmalemma, reticolo endoplasmatico e tonoplasto permettono passaggio di acqua e di altre sostanze tra cui H2O2;
RBOH: Acronimo di Respiratory Burst Oxydase Homolog; RBOHD e RBOHF sono due forme di RBOH.
Enzima NADPH Ossidasi (NOX);
SA : Acido salicilico.
Umberto Mazzucchi è stato professore ordinario di Patologia Vegetale alla Università degli Studi di Bologna dal 1989 al 2010. Docente del corso di Patologia Vegetale e di alcuni corsi specialistici di materie fitopatologiche, ha svolto ricerche sulle interazioni ospite-patogeno nel processo infettivo e sulla risposta immunitaria delle piante. Pensionato dal 2010, come professore dell’Alma Mater ha svolto seminari occasionali e cicli di lezioni in corsi ufficiali della Università di Bologna.