Appunti sul sistema immunitario delle piante (Seconda parte)
di Mazzucchi Umberto

Il secondo livello contraddistinto tradizionalmente dalla sigla ETI (Effector Triggered Immunity) è gestito da recettori intracellulari, proteine multidominio caratterizzate da un dominio centrale conservato NB-ARC ligando a nucleotidi (Nucleotide Binding), un dominio C terminale LRR ricco di leucina (Leucine Reach Repeat) e un dominio N terminale di tre tipi di base: TIR, CC o RPW8-simile (es. ADR1 e NRG1) [ Toll Interleukin-1 Receptor; Coiled-Coil; RPW8-like ]; poche non possiedono tutti e tre i domini (es. solo TIR in RBA1). Sono già noti anche tipi di NLR oltre ai tre descritti aventi domini particolari integrati. Il dominio centrale NB ha proprietà ATP-asica e funge da interruttore molecolare, inattivo con ADP, attivo con ATP. In generale i primi due tipi operano da sensori di effettori microbici, quelli del terzo tipo segnalano a valle di parecchie NLR sensori e sono denominati helper ovvero ausiliari ( 14 ). Questi tre tipi di proteine sono indicati genericamente con la sigla NLR [ Nucleotide binding domain and Leucine rich Repeat ]; più sinteticamente con le sigle TNL ,CNL e RNL quelle con N terminale TIR; CC e RPW8-simile rispettivamente.( Fig.3 ).
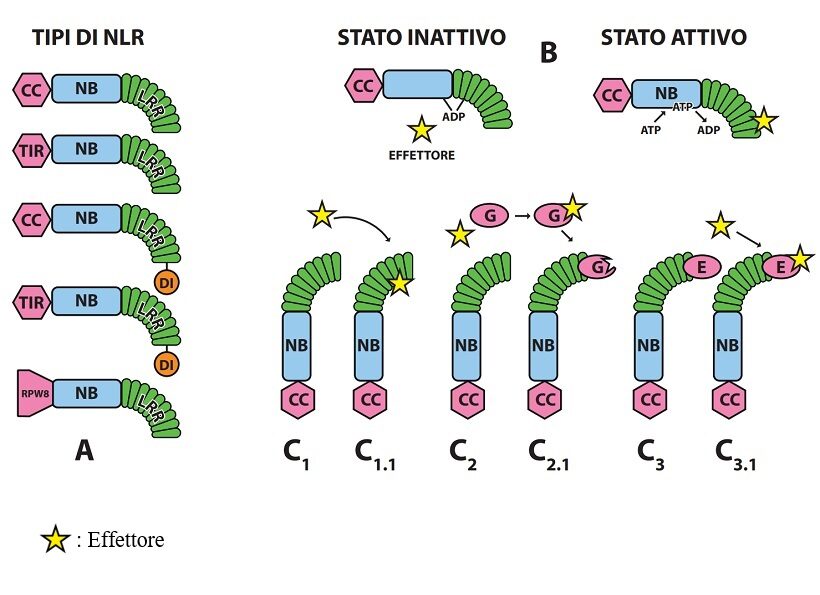 Fig. 3. Tipi dei recettori intracellulari NLR delle piante e loro attivazione nel corso della interazione con gli effettori dei patogeni. A-Tipi di proteine NLR più comuni (a destra estremità C, a sinistra estremità N); Sono già noti altri tipi di NLR con particolari domini integrati ( DI ) in vari punti (es. alla estremità di NB, su LRR e alla estremità CC o TIR). B– Attivazione di una NLR a seguito interazione con l’effettore e sostituzione di ADP con ATP. C1-C1.1; Attivazione diretta di una NLR dopo interazione con l’effettore; C2-C2.1 Attivazione indiretta con guardia (G); C3-C3.1 ; Attivazione indiretta con esca ( E ) ( 6 ). La guardia G è alterata dall’effettore e la NLRs ne percepisce le modifiche attivandosi; l’esca E ha conformazione già predisposta alla interazione con l’effettore; può essere libera o – come in figura – integrata con la NLRs. Sulla differenza tra le strategie di guardia ed di esca libera non tutti concordano. Le NLRs attivate sono predisposte a formare dimeri, omo-oligomeri o etero-oligomeri associandosi a NLRh generando segnali che attivano vie metaboliche per la messa a punto di risposte di difesa (potenziando eventualmente quelle di PTI) o disfunzioni tali da alterare gravemente la omeostasi avviando a morte la cellula.
Fig. 3. Tipi dei recettori intracellulari NLR delle piante e loro attivazione nel corso della interazione con gli effettori dei patogeni. A-Tipi di proteine NLR più comuni (a destra estremità C, a sinistra estremità N); Sono già noti altri tipi di NLR con particolari domini integrati ( DI ) in vari punti (es. alla estremità di NB, su LRR e alla estremità CC o TIR). B– Attivazione di una NLR a seguito interazione con l’effettore e sostituzione di ADP con ATP. C1-C1.1; Attivazione diretta di una NLR dopo interazione con l’effettore; C2-C2.1 Attivazione indiretta con guardia (G); C3-C3.1 ; Attivazione indiretta con esca ( E ) ( 6 ). La guardia G è alterata dall’effettore e la NLRs ne percepisce le modifiche attivandosi; l’esca E ha conformazione già predisposta alla interazione con l’effettore; può essere libera o – come in figura – integrata con la NLRs. Sulla differenza tra le strategie di guardia ed di esca libera non tutti concordano. Le NLRs attivate sono predisposte a formare dimeri, omo-oligomeri o etero-oligomeri associandosi a NLRh generando segnali che attivano vie metaboliche per la messa a punto di risposte di difesa (potenziando eventualmente quelle di PTI) o disfunzioni tali da alterare gravemente la omeostasi avviando a morte la cellula.
Ogni specie vegetale è dotata di centinaia di NLR codificate da altrettanti geni, risultato della pressione selettiva esercitata nel tempo dagli effettori dei patogeni (es. 160 in A. thaliana, 398 nella patata, 445 nel riso, 235 nel pomodoro, 930 nel melo, 355 nella vite, 355 nel pesco, etc, ( 17 ); le TNL sono assenti in molti genomi delle monocotiledoni. Le cellule animali sono meno dotate. Tradizionalmente le NLR più note sono quelle coinvolte nelle interazioni ospite-patogeno incompatibile e in particolare quelle responsabili dei riconoscimenti di effettori scatenanti la reazione di ipersensibilità [HR; Hypersensitive Reaction] ovvero le conseguenze del contatto tra i prodotti dei geni R di alta resistenza della cellula (cioè appropriate NLR) e i prodotti di geni di avirulenza di patogeni (cioè particolari effettori). In realtà le ricerche dell’ultimo ventennio hanno messo in luce progressivamente come il ruolo che le NLR svolgono nella risposta immunitaria sia assai sofisticato e si integri perfettamente con le risposte di primo livello potenziandolo.
Le NLR si distinguono in NLR sensori [ NLRs; NLR sensor ] e NLR assistenti [ NLRh; NLR helper]. Le NLRs si legano all’effettore del patogeno, le NLRh si attivano per trasmettere “a valle” il segnale generato dall’avvenuto legame tra NLRs e l’effettore. Le NLR possono operare singole o aggregarsi tra loro (es. in coppia, una NLRs con una NLRh; in gruppo alcune NLRs con una NLRh; etc.) ( 1 ). La proprietà di una NLR di causare morte cellulare è spesso positivamente correlata a quella di formare oligomeri (es. tetrameri, pentameri).
Le NLR, ubicate nel citoplasma o nel nucleo, alcune probabilmente precostituite e in stato di pre-attivazione, altre sintetizzate durante il primo livello, provvedono a monitorare la presenza di effettori introdotti o iniettati dai patogeni all’interno della cellula. Si ammette che possano fare la spola tra nucleo e citoplasma e che la loro omeostasi sia strettamente regolata; loro eccesso o inefficienza per usura sono evitati con ubiquitinazione e distruzione in proteasoma (13, 20).
Le modalità note di funzionamento delle NLR come recettori immunitari intracellulari sono quattro: diretta, con proteina di guardia, con proteina esca e con proteina esca integrata [Direct, Guard, Decoy ,Integrated Decoy] ( 6 ) (Fig.3).
Nella strategia diretta le NLR possono operare singole, a coppia o associate. Operando singole una NLR funge da sensore e da assistente ovvero è in grado sia di legarsi all’effettore, sia di attivarsi per trasmettere a valle il segnale; operando a coppia, una funge da sensore, l’altra da assistente per la ricezione e trasmissione del segnale. Si ammette che alcune NLR possano legarsi tra loro creando una piccola rete dove siano presenti NLR sensore e NLR assistente.
Nella strategia con proteina di guardia una NLR è abbinata ad una proteina bersaglio dell’effettore detta guardia che legandosi all’effettore altera la propria conformazione; la modifica della guardia è percepita dalla NLR che funge da sensore e da assistente attivandosi.
Nella strategia con proteina esca una proteina della pianta è un mimo della molecola bersaglio dell’effettore, funge da esca per l’effettore, si lega ad esso, si altera di conformazione e poi, fingendo d’essere l’effettore vero, si lega alla NLRs che, percependone la modifica, si attiva.
La strategia di esca integrata differisce dalla precedente per il fatto che il dominio della proteina esca ( ID ) è integrato nella NLR. L’integrazione può aver luogo in differenti posizioni della NLR in relazione al sistema ospite-patogeno: alla estremità C (LRR) o N (TIR o CC) oppure tra l’estremità N (TIR o CC) e il dominio NB oppure sostituendo i domini TIR o CC.
In generale riguardo ai patogeni, gli effettori dei batteri sono riconosciuti per lo più indirettamente per mezzo della loro attività enzimatica su esche dell’ospite oppure su esche integrate, mentre gli effettori dei funghi lo sono per via diretta o per esca integrata ( 19 ).
Una NLR può essere attiva o inattiva. É inattiva quando il dominio NB è vincolato al dominio LRR per la presenza di ADP contraente una serie di legami tra i due domini; quando l’effettore si lega direttamente o indirettamente al dominio LRR, ADP è sostituito da ATP, i due domini si svincolano e la NLR diviene attiva modificando la sua conformazione. L’attivazione delle NLR promuove tra loro aggregazione in dimeri o oligomeri, ovvero segnalosomi, denominati inflammasomi nelle cellule animali, resistosomi nelle cellule vegetali. Per creare il segnale da trasmettere a valle la NLRs attivata necessita comunemente di aggregarsi con una NLR h.; è possibile, tuttavia, che certe NLRh formino omo-oligomeri inducenti resistenza ( 19 ).
Le segnalazioni a valle delle NLR attivate vanno ad innescare attività fisiologiche volte a contrastare gli effetti negativi, assimilabili a sabotaggi, causati dagli effettori, oppure gravi disfunzioni cellulari culminanti con la morte della cellula. Entrambi i ruoli immunitari sono difensivi: nel primo caso tendono a potenziare le risposte avviate o già attive nel primo livello della risposta salvaguardando per quanto possibile la omeostasi cellulare. Modelli proposti prevedono, ad esempio, che alcune possano assicurare funzionalità della rete MAPK di segnalazione del primo livello sabotata da effettore ( 2 ) o che annullino l’inibizione fatta da un effettore sulla regolazione negativa di enzima chiave per la via metabolica dell’etilene, cardine della risposta di primo livello ( 24 ); nel secondo caso CNL e TNL attivate, assemblatesi in corrispondenza dei loro domini CC o TIR in pentameri o tetrameri, con i loro segnali a valle inducono morte della cellula, espressione di riconoscimento non-self in negativo, allo scopo di escludere l’entità non-self incompatibile dal tessuto di cui la cellula fa parte. Le modalità di innesco variano in rapporto alla/e NLR e all’effettore coinvolti durante la interazione ospite patogeno del particolare patosistema. ( 3 ).
In A. thaliana la CNLs ZAR1 con esca integrata RKS1, fosforilata (PBL2UMP) e attivata dall’effettore AvrAC di X. campestris, forma un oligomero pentamero a forma di imbuto, di diametro 5 nm, avente breve cannello formato da 5 estremità CC e bordo della imboccatura da 5 effettori legati alle esche ( Fig.4 ). Il breve cannello formato dalle 5α eliche degli N-terminali di Zar1 si inserisce nello spessore del doppio strato fosfolipidico di membrane generando un poro ( E ) costituente canalicolo per lo ione calcio che per l’alto gradiente di concentrazione tra apoplasto e simplasto (da 10-4M a 10-7M) penetra abbondante nel citoplasma alterando gravemente o annullando la compartimentazione cellulare con esito letale ( 4, 23 ); di fatto l’aggregato pentamerico di ZAR1, inseritosi nel plasmalemma dei protoplasti di Arabidopsis, causa influsso di calcio, accumulo di ROS, distruzione di vacuoli e cloroplasti, perdita di integrità del plasmalemma e infine rottura della cellula (Fig.4 ). In realtà, possibili membrane bersaglio potrebbero essere quelle di altri comparti cellulari a concentrazione di Ca2+ superiore a quella del citosol.
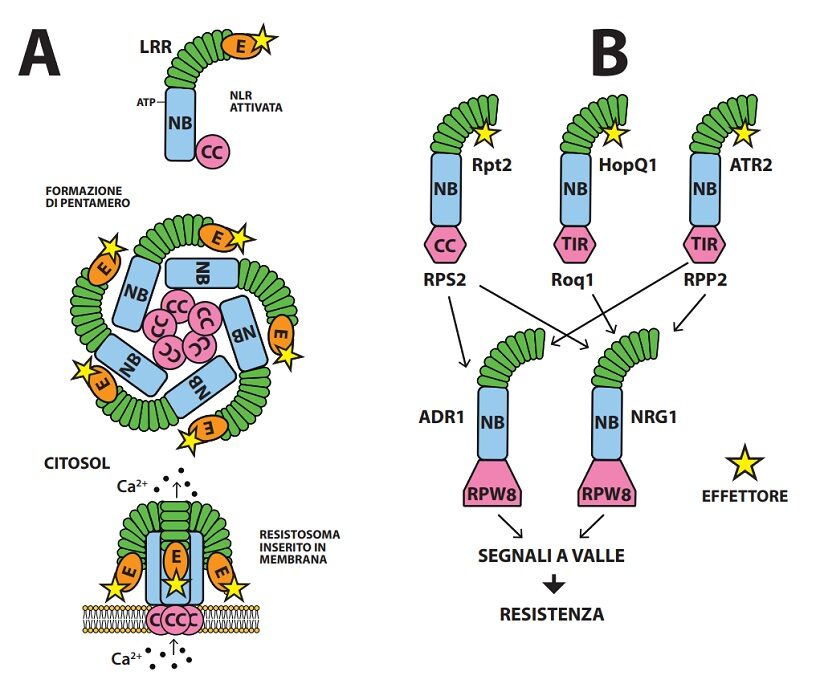
Fig.4. A– Formazione di un resistosoma da parte di una NLR attivata da effettore e fosforilata. Il resistosoma pentamero si inserisce nel plasmalemma con le estremità CC assemblate creando un poro mettente in comunicazione apoplasto con citoplasma. Il modello è stato messo a punto dagli studi sulla NLRs ZAR1 ( 4 ). B– Trasmissione del segnale di avvenuto riconoscimento di un effettore da parte di una CNL (RPS2) e due TNL (Roq1 e RPP2), attivate rispettivamente dagli effettori Rpt2, HopQ1 e ATR2. Le tre NLRs interagiscono con le NLRh per trasmettere il segnale a valle. Si ritiene che le due TNL trasmettano comunemente via NRG1, la CNL via ADR1 e in parte NRG1. I geni codificanti NRG1 e ADR1 sono conservati nelle Angiosperme ( 5 ).
Più complessi sono i segnali a valle delle TNLs. Attivate da effettori, le TNLs formano oligomeri (es. tetrameri) assemblando i loro domini TIR che così disposti mostrano attività enzimatica tagliando il NAD+ con formazione di nicotamide, ADP-ribosio e varianti cicliche di ADP-ribosio. È opinione corrente che a questo punto la segnalazione prosegua con l’intervento di RLN h, in particolare ADR1 e NRG1 (entrambe con dominio RPW8-simile al terminale N) e di una proteina lipasi-simile EDS1. Il modello prevede che i prodotti ciclici del taglio del NAD+ si associno a due complessi o moduli (NRG1-EDS1-SAG101) e (ADR1-EDS1-PAD4), dove le proteine SAG 101 e PAD4 sono ausiliarie, ma non NLR. Così attivate, nei moduli con ADR1 e NRG1 formerebbero resistosomi che inseriti in plasmalemma fungerebbero da canalicoli del Ca 2+. Questa composita serie di segnalazioni generate dalle TNLs attivate darebbe luogo sia a trascrizioni per l’approntamento di difese potenziando il primo livello, sia a morte cellulare ( 10, 14, 22 ).
Le conoscenze sulle NLR maturate negli ultimi anni sono risultato di brillanti ricerche: per gli interventi correttivi delle disfunzioni indotte dagli effettori in PTI ( 2, 21, 24 ); per i riconoscimenti in negativo ( 4, 7, 23 ). Queste ricerche ed altre hanno concorso a mettere in luce come PTI e ETI esprimano fasi perfettamente integrate della risposta immunitaria innata dove l’acido salicilico gioca ruolo fondamentale ( 15 ). I dati indicano che il sinergismo tra gli strumenti di difesa messi in atto dall’ uno e dall’altro livello avrebbe luogo con un picco dopo circa 120-180 minuti dall’inizio della interazione ( 16 ).
L’ampiezza delle risposte dei due livelli varia comunque con la temperatura ambiente: il primo livello più ampio tra 23-32 C° (maggior numero di MAMPs), il secondo tra 15-25 C° (maggior numero di effettori) ( 9 ). In generale i ritmi circadiani (temperature, luce, umidità) influenzano sia la risposta immunitaria che l’attività dei patogeni.
Infine è opportuno tener presente che la intensità delle risposte immunitarie innate è soggetta a controllo quantitativo NMD (Nonsense-Mediated Decay) ad evitare che un eccesso di trascrizioni e relative traduzioni di geni connessi alla difesa possa andare a scapito di altre attività, crescita e sviluppo della pianta in primo luogo; allo scopo i loro mRNA sono marcati in testa o in coda con sequenze “intraducibili” in modo che le proteine tronche derivanti siano destinate alla distruzione in proteasoma ( 11 ).
Nonostante i recenti progressi delle conoscenze rimangono ancora per maggior parte sconosciuti quali siano nel corso di ETI i completi percorsi a valle dei segnali trasmessi dalle NLR attivate e i loro effetti sulla omeostasi cellulare. La risposta immunitaria descritta in questi appunti è quella più studiata. Meno conosciuta è quella associata alle vescicolazioni sia per la dinamica delle vescicole, sia per i bersagli delle molecole che traslocano, RNA a catena breve in primo luogo (Rivista di Agraria N.352,15/10/2021). I siRNA (Small Interfering RNA) della pianta presenti entro le vescicole potrebbero svolgere ruoli critici tanto da condizionare i patogeni a produrre effettori volti a bloccarne la produzione ( 8, 12 ).
Gli strumenti del sistema immunitario delle piante sono di grande attualità per la ricerca. Le conoscenze sulle NLR e loro applicazioni contribuiranno certamente alla messa a punto di piante più resistenti alle malattie.
Lavori citati
1- Adachi H. et al., 2019. Current Opinion in Plant Biology 50, 121-131.
2- Bi G. e J. M. Zhou, 2017. Cell Host & Microbe 21, 270-273.
3- Bi G. e J. M. Zhou, 2021. Annual Review of Phytopathology 59, 239-263.
4- Bi G. et al., 2021. Cell 184, 3528-3541.
5- Castel B. et al.,2019. New Phytologist 222,966-980.
6- Cesari S.,2018. New Phytologist 219, 17-24.
7- Chang M. et al., 2019.Trends in Plant. Science 24, 12, 1069-1072.
8- Chen Y. e O. Rechavi, 2022. Nature Review Molecular Cell Biology 23, 185-203.
9- Cheng C. et al., 2013. Nature Communications 4, Art. 2530.
10- Jacob P. et al.,2021. Science 373, 420-425.
11- Kawa D. 2020. The Plant Cell 32, 4 , 803-804.
12- Hou Y et al.,2019. Cell Host & Microbe 25,153-165.
13- Li X. et al., 2015. Current Opinion in Immunology 32,114-121.
14- Maruta N. et al., 2022. Immuno Genetics 74, 5-26.
15- Ngou B. P.M.et al., 2022.Trends in Plant Science 27, 255-273.
16- Ngou B. P.M et al., 2021. Nature 592,110-115
17- Ngou B. P.M. et al., 2022. The Plant Cell 00,1-32.
18- Sanabria N.M. et al., 2010.Self/nonself 1,1,40-54.
19- Saur et al., 2021. Nature Reviews Immunology 21 (5), 305-318).
20-Van Versche S. et al., 2020. Plant Communications 1(4),100090.
21-Yu M. et al., 2021. Plant Physiology 187, 2852-2864.
22- Xia S.et al., 2021. Journal of Genetics and Genomics,48, 429-432.
23-Wang J. et al.,2019. Science 364, eaav5870, 5 Aprile, 1-11.
24- Zhai K..et al., 2022. Nature, 601, 245-25.
Glossario
Non-Self : Una biomolecola o un organismo che la pianta percepisce essere di diversa origine o in condizione differente dal normale, riconosciuti durante la propria attività metabolica per conservare la omeostasi ( 18 ).
Sistema immunitario innato: Capacità di percepire come segnale di pericolo il non sè e il sé danneggiato o alterato e di rispondere, usufruendo di appropriati strumenti di sorveglianza.
CC: Coiled-Coil; Tir:Toll Interleukin-1 Receptor; NBS: Nucleotide Binding ;
LRR: Leucine Reach Repeat; ATP: Adenosina trifosfato; ADP: Adenosina difosfato;
NAD: Nicotamide adenina dinucleotide; HR: Morte cellulare per ipersensibilità.
Plasmalemma: Sinonimo di membrana citoplasmatica. Nel testo per la struttura si fa riferimento alla teoria del mosaico fluido rivisitata (Nicolson G.L,2014; Gronnier et al.,2018).
Apoplasto: Nei tessuti vegetali, tutto ciò che rimane all’esterno della membrana citoplasmatica (o plasmalemma) delle cellule (pareti, spazi intercellulari, trachee, tracheidi).
Simplasto: Nei tessuti vegetali, tutto ciò che rimane all’interno della membrana citoplasmatica: l’insieme dei protoplasti, collegati tra loro dai plasmodesmi, inclusi quelli dei tubi cribrosi del floema.
ROS: Forme reattive dell’ossigeno: anione superossido, acqua ossigenata, radicale idrossile.
Ubiquitina: Piccola proteina che si lega singola o a catenella alle proteine “difettose” o “usurate” da distruggere. Le proteine marcate ovvero “ubiquitinate” sono avviate al proteasoma per essere distrutto.
Proteasoma: All’interno delle cellule, struttura cilindrica tubolare costituita da proteine che espongono nella cavità interna siti catalitici per la distruzione delle proteine. Le proteine marcate con ubiquitina entrano all’imbocco del “tubo” e percorrendo la cavità interna vengono via via degradate per rottura dei legami tra gli amminoacidi. Alla uscita, brevi catene di amminoacidi sono a disposizione della cellula.
Recettore: Struttura capace di reagire a stimoli dando luogo ad una reazione caratteristica.
Trasduzione: Una molecola segnale esterna attiva uno specifico recettore dentro o alla superficie della cellula. Questo recettore va ad attivare una via biochimica dentro la cellula, creando una risposta.
Umberto Mazzucchi è stato professore ordinario di Patologia Vegetale alla Università degli Studi di Bologna dal 1989 al 2010. Docente del corso di Patologia Vegetale e di alcuni corsi specialistici di materie fitopatologiche, ha svolto ricerche sulle interazioni ospite-patogeno nel processo infettivo e sulla risposta immunitaria delle piante. Pensionato dal 2010, come professore dell’Alma Mater ha svolto seminari occasionali e cicli di lezioni in corsi ufficiali della Università di Bologna.