Malattie infettive delle piante e virulenza dei patogeni (prima parte)
di Umberto Mazzucchi

Primi sintomi (macchie d’olio) al termine del periodo di incubazione di infezioni di peronospora (Plasmopara viticola) su foglia di vite
Lo stato di malattia infettiva di una pianta è il risultato di una interazione multifattoriale dove una entità microbica prevalente, il patogeno, riesce ad esprimere efficacemente fattori di virulenza (effettori) del proprio genoma in appropriato e favorevole contesto ambientale, microbiomiale e immunitario (2,7,10,11,13) (Fig.1). In una malattia infettiva si distinguono tradizionalmente tre fasi iniziali: penetrazione, ancoramento e incubazione. Durante l’incubazione ha luogo la progressiva colonizzazione microbica, locale e/o sistemica, della pianta ospite in assenza di sintomi visibili. Al termine della incubazione compaiono i primi sintomi che poi evolveranno nel tempo. L’ancoramento e l’incubazione sono le fasi dove la virulenza del patogeno svolge ruolo determinante.
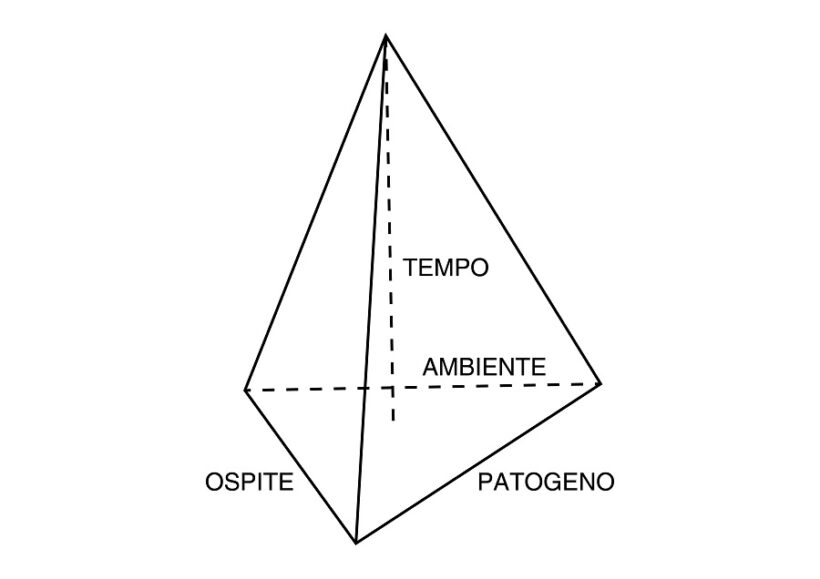
Fig. 1 – Piramide di malattia di un sistema omologo. I lati di base rappresentano pianta ospite, patogeno e ambiente, l’altezza il tempo di interazione. Il volume della piramide esprime la quantità di malattia risultante. La pianta ospite può essere più o meno suscettibile o resistente in funzione della sua risposta immunitaria; il patogeno più o meno virulento per il tipo e la quantità di effettori che riesce ad esprimere; l’ambiente ha varie componenti: terreno, temperatura, disponibilità idrica, umidità relativa, fotoperiodo, fattori metereologici, luce solare, uomo, microbioma, etc. Di particolare importanza il microbioma epifita e endofita della pianta ospite, di cui fa parte anche il patogeno.
La virulenza è la misura della patogenicità. Il grado di virulenza del ceppo di un fitopatogeno si valuta tradizionalmente con la fitopatometria misurando l’entità dei sintomi tipici visibili esprimenti deviazioni fenotipiche dallo stato di normalità valutando incidenza (es. indice di mortalità %) o intensità (es. scala di classi di intensità) (9). Oltre alla tradizionale osservazione ad occhio nudo o con lente a basso ingrandimento da parte del fitopatologo professionista, il rilievo dei sintomi per valutare l’intensità può esser fatto per via informatica con sensori di immagine RGB, MSI o HSI (1) su singolo organo, su intera pianta e su intero campo; l’uso di droni è possibile su ampie aree. Per valutare comparativamente in condizioni strettamente controllate (cella climatica, dose d’inoculo standardizzata, etc) la virulenza dei ceppi di un patogeno (o il grado di resistenza delle cultivar di una specie vegetale) si fa riferimento al modello piramidale (Fig.1).
In ogni caso di malattia infettiva in condizioni naturali, la specie vegetale e l’entità causale prevalente esprimono un sistema omologo; la specie vegetale è detta specie ospite naturale, l’entità causale si definisce patogeno omologo (es. Plasmopara viticola – Vite). Una entità biotica fitopatogena e una specie vegetale non suo ospite naturale esprimono un sistema eterologo che non dà luogo a malattia (es. Plasmopara viticola – Melo). Nei sistemi eterologhi la pianta si definisce immune nei confronti della entità fitopatogena. La virulenza di un patogeno ha pertanto senso facendo riferimento ad un sistema omologo.
In un sistema omologo l’ancoramento è il momento cruciale. Venuto a contatto con le pareti delle cellule vegetali negli spazi intercellulari o pervenuto passivamente via vettore nel loro citoplasma, il patogeno sollecita appropriati recettori rispettivamente apoplastici e simplastici. Entro 1-3 minuti si avvia la risposta immunitaria della pianta, che per il momento riconosce semplicemente presenza di entità estranea (non self). Nei minuti successivi fino a circa 3-6 ore ha luogo la vera e propria interazione tra i due partner contraddistinta da liberazione di effettori da parte della entità microbica e da una serie di risposte immunitarie da parte della pianta ospite.
Il grado di virulenza di un patogeno dipende sia dal numero e dal tipo di bersaglio dei fattori di virulenza o effettori codificati nel suo genoma, sia dalla attività di altri microbi a lui associati presenti nella nicchia dove ha inizio e sviluppa l’infezione, oltre che dalle condizioni ambientali e dalla locale risposta immunitaria della pianta. Quando in un sistema omologo il risultato finale della interazione comporta la morte di una o poche cellule della pianta ospite (es. meno di 50) non si hanno sintomi visibili e non c’è malattia; la lesione si rende visibile solo a forte ingrandimento o al microscopio ed il risultato della interazione è espressione di alta resistenza della pianta ospite (reazione di ipersensibilità; HR; Hypersensitive Reaction).
In base alla loro funzionalità possono distinguersi tre tipi di effettori: di virulenza, di avirulenza e necrotrofici. Gli effettori di virulenza espressi da patogeni biotrofi ed emibiotrofi nel corso di tutta o parte della patogenesi sono essenziali per il successo dell’ancoramento e della infezione (Fig.2). Gli effettori di avirulenza, anch’essi espressi da patogeni biotrofi ed emibiotrofi, in particolari combinazioni cultivar ospite/ceppo del patogeno, sono responsabili dell’insuccesso della infezione scatenando una violenta ed efficace reazione di difesa della pianta ospite (HR) e non causano, in condizioni naturali, sintomi visibili di malattia. Ad alta dose di inoculo, applicata ad hoc su area delimitata di tessuto (es.su foglia) la HR si rende visibile in certi sistemi già dopo 24h a temperatura ambiente come zona di tessuto necrotico.
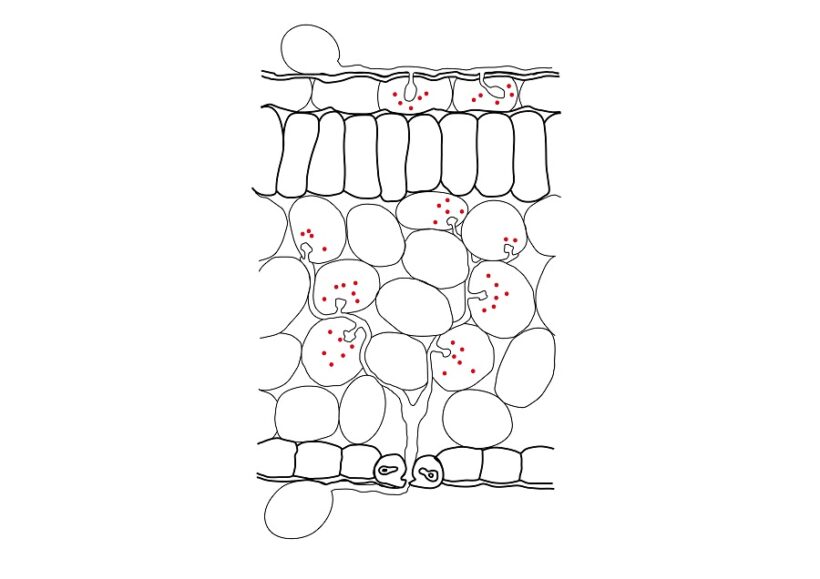
Fig. 2 – Sezione di foglia oggetto di infezione da parte di un fungo e di un oomicete. Un oidio ha infettato due cellule epidermiche formando austori al loro interno (in alto). Una peronospora penetrata per via stomatica ha sviluppato micelio intercellulare e austori all’interno di cellule del mesofillo (in basso). Entrambi i patogeni dagli austori hanno traslocato effettori (punti rossi) entro le cellule vegetali condizionandone il metabolismo a proprio favore.
Una HR indotta da un ceppo di patogeno omologo o da un suo effettore testimonia una interazione omologa incompatibile; di fatto, effettori di avirulenza possono essere usati per saggiare germoplasmi di piante e selezionare forme resistenti a malattie.
Gli effettori necrotrofici, espressi da patogeni necrotrofi (es. tossine di funghi Dothideomycetes) (4) causano morte di numerose cellule vegetali, successo della infezione e comparsa di sintomi di malattia. Sia gli effettori di avirulenza che quelli necrotrofici legandosi a particolari recettori della cellula vegetale (citoplasmatici, talora apoplastici) ne inducono la morte. Per i patogeni necrotrofi le estese morti cellulari si rendono visibili, costituiscono sintomi di malattia ed esprimono suscettibilità; per i patogeni biotrofici e emibiotrofici; la morte di singole o di poche cellule non sono visibili ed esprimono alta resistenza.
Gli effettori di oomiceti, funghi e batteri, spesso decine o centinaia per ogni specie, sono comunemente di natura proteica e hanno per lo più come bersagli la proteostasi cellulare (sintesi, trasporto, traduzione, modifiche post-traduzionali, ripiegamento, degradazione via proteasoma, autofagia (4, 8). Comunemente è indotto stress proteotossico contraddistinto da accumulo abnorme di proteine prive di conformazione o di errata conformazione nel reticolo endoplasmatico, nei mitocondri e nei cloroplasti. L’insuccesso dei meccanismi di controllo di qualità delle proteine da parte della cellula ne compromette la sopravvivenza e, oltre una certa soglia, l’avvia alla morte.
Lo scopo degli effettori è quello di dirottare fasi del metabolismo della cellula ospite creando un ambiente favorevole alla colonizzazione e alla proliferazione del patogeno, determinando il successo della infezione. Rilevando il repertorio di effettori dei differenti ceppi di un patogeno è stato possibile identificare gli effettori principali di quella specie.
Gli effettori sono traslocati dal patogeno per lo più nel simplasto delle cellule ospiti, in minoranza nell’apoplasto a difesa dagli enzimi degradativi della pianta colà presenti (proteasi, glucanasi, chitinasi) (es. Cladosporium fulvum). I batteri traslocano gli effettori per mezzo di appropriati sistemi di secrezione associati alle loro pareti (vedi oltre, Parte seconda). Gli oomiceti e i funghi all’interno di vescicole (esosomi; EVs) liberate per esocitosi dalle pareti degli austori o delle ife intracellulari negli spazi attorno agli austori e alle ife; le vescicole sono poi introdotte per endocitosi attraverso le membrane citoplasmatiche nel citoplasma delle cellule vegetali (vedi Parte seconda, Fig.3).
Le piante rilevano gli effettori loro trasferiti per mezzo di recettori per lo più simplastici comunemente indicati con la sigla NLR (NOD-like Receptor), in minor numero apoplastici per certi patogeni sottocuticolari (es.Venturia inaequalis) indicati con sigla ETD (Effector Triggered Defence) (12). Dato l’alto numero di effettori per patogeno e la loro variabilità tra i patogeni omologhi di uno stesso ospite, le piante sono state soggette ad evoluzione dei loro recettori. Gli effettori possono avere o meno proprietà enzimatiche; la ricezione può pertanto essere diretta (riconoscimento molecolare semplice o con esca) o indiretta (riconoscimento del prodotto di reazione) (5). La ricezione degli effettori avvia la fase più intensa e “rischiosa” della risposta immunitaria innata di ogni cellula vegetale agli agenti di malattie infettive, contraddistinta dalla sigla ETI (Effector Triggered Immunity); nelle interazioni omologhe incompatibili la morte ipersensitiva (HR) ne è inevitabile conseguenza. Durante l’interazione la produzione e la traslocazione degli effettori da parte del patogeno varia nel tempo e nello spazio (es. nicchie tissutali temporanee durante la colonizzazione) e si può supporre che ogni effettore abbia una vita media condizionata dai meccanismi distruttivi messi in atto dalla cellula vegetale o talora dallo stesso patogeno.
La produzione di effettori varia con la temperatura ambiente sia durante il giorno, sia nel corso delle stagioni. Dato un intervallo termico di crescita del patogeno, la ricerca indica che alle temperature più basse la produzione di effettori sia maggiore. D’altra parte anche la risposta immunitaria delle piante (organismi eterotermi a differenza dei mammiferi) cambia al variare della temperatura ambiente e delle ore del giorno (ritmo circadiano) con un picco secondo la specie vegetale e il tipo di patogeno.
Evidentemente da inizio ancoramento in poi numerosi sono i fattori condizionanti il decorso e il risultato della interazione ospite-patogeno, tutti inclusi comunque nel modello piramidale (Fig.1).
I virus aventi genomi di piccole dimensioni posseggono pochi effettori. Essenziali per il successo della infezione sono le proteine soppressori del silenziamento genico (RNA Silencing Suppressors o RSS) e le proteine di movimento (6). Le RSS legandosi ai dsRNA o ai siRNA duplex o ad altri componenti del ciclo inibiscono la biogenesi del siRNA o la formazione dei complessi RISC inducenti silenziamento con taglio del RNA messaggero del virus (RNA-Induced Silencing Complex), strumento di difesa antivirale della pianta agli inizi della infezione. Le proteine di movimento consentono ai virus di superare barriere anatomiche offerte dalla ristrettezza dei plasmodesmi e dei pori delle pareti aumentando il limite di esclusione nel primo caso, creando una struttura tubolare di trasferimento attraverso nel secondo caso.
FINE PRIMA PARTE
Lavori citati (prima parte)
1- Bock C.H. et al.,2020. Phytopathological Research 2:9,2-30.
2- Cheng C. et al., 2013. Nature Communications 4,2530.
3- Depaepe T. et al.2021.Trends in Plant Science 26,4,338-351.
4- Faris J.D. e T.L. Friesen 2020. Current Opinion in Plant Biology 56, 74-80.
5- Figueroa M. et al., 2021.Current Opinion in Plant Biology 62, Art.102054.
6- Giunchedi L. et al.,2007. Elementi di Virologia Vegetale. 333pp. Piccin Editore,Padova.
7- Hua J.,2013. Current. Opinion in Plant Biology 16,406-413.
8- Langin G.et al.,2020. Trends in Microbiology 28,7,523-535.
9- Matta et al., 1986. Fondamenti di Patologia Vegetale. 494pp., Patron Editore, Bologna.
10- Methot P.O. e S. Alizon, 2014.Virulence,5 (8),775-785;
11- Mwimba M. et al.,2018. Nature Communications 9,4290.
12- Stotz H.U. et al., 2014.Trends in Plant Science19,8,491-500.
13- Vandenkoornhuyse et al.,2015. New Phytologist 206,1196-1206.
Glossario
Biotrofo: un organismo che può vivere e moltiplicarsi solo su un altro organismo vivente.
Emibiotrofo: un organismo che vive solo una parte del suo ciclo (più spesso la prima parte) come biotrofo.
Necrotrofo: un organismo che uccide i tessuti mentre cresce loro attraverso in modo da colonizzare un substrato morto.
Apoplasto: Nei tessuti vegetali, tutto ciò che rimane all’esterno della membrana citoplasmatica (o plasmalemma) delle cellule (pareti, spazi intercellulari, trachee, tracheidi).
Simplasto: Nei tessuti vegetali, tutto ciò che rimane all’interno della membrana citoplasmatica: l’insieme dei protoplasti, collegati tra loro dai plasmodesmi, inclusi quelli dei tubi cribrosi del floema.
Microbioma di una pianta: L’insieme dei microrganismi (inclusi i patogeni) e dei loro genomi (batteri, oomiceti, funghi, virus, viroidi, etc.), epifiti e endofiti, viventi in associazione con la pianta.
Olobionte: Pianta sana in equilibrio con il suo microbioma.
Plasmalemma: Sinonimo di membrana citoplasmatica.
Effettore: Tutte le proteine e le piccole molecole (es. tossine) del patogeno che alterano struttura e funzioni della cellula ospite. Le alterazioni possono facilitare l’infezione (fattori di virulenza) pur sollecitando accentuate risposte di difesa della pianta; in certi casi fino a bloccare l’infezione (fattori di avirulenza).
Umberto Mazzucchi è stato professore ordinario di Patologia Vegetale alla Università degli Studi di Bologna dal 1989 al 2010. Docente del corso di Patologia Vegetale e di alcuni corsi specialistici di materie fitopatologiche, ha svolto ricerche sulle interazioni ospite-patogeno nel processo infettivo e sulla risposta immunitaria delle piante. Pensionato dal 2010, come professore dell’Alma Mater ha svolto seminari occasionali e cicli di lezioni in corsi ufficiali della Università di Bologna.