Le Zeoliti
di Donato Ferrucci
“Zeolite”, termine coniato nel 1756 dallo scopritore, il mineralogista svedese Alex F. Cronstedt, dal greco “bollire” (zein) e “pietra” (lithos), richiama il comportamento di questi materiali che, se sottoposti a riscaldamento, sembrano bollire per la veloce perdita dell’acqua che contengono.
Le zeoliti sono minerali microporosi ad impalcatura tridimensionale ti tipo tetraedrico. Dal punto di vista chimico, le zeoliti sono degli allumino-silicati idrati di metalli alcalini e/o alcalino-terrosi, appartenenti alla classe dei tectosilicati.
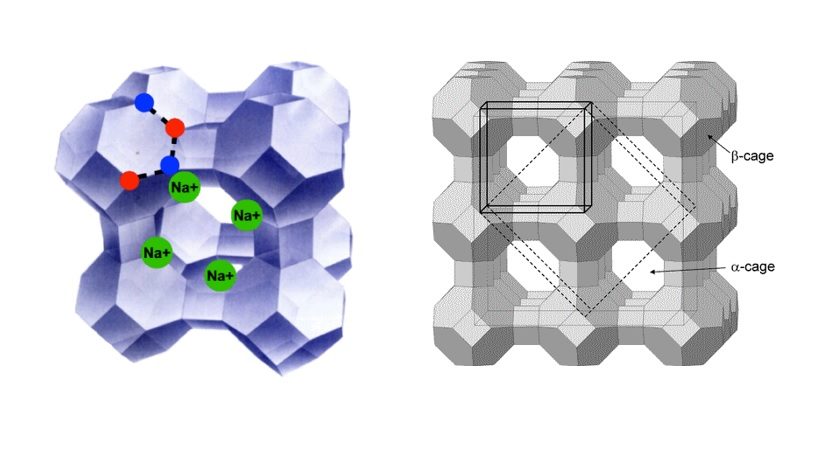
Le zeoliti costituiscono una famiglia di minerali che presentano una struttura cristallina molto aperta, con presenza di cavità il cui volume varia dal 30 al 50% del volume dell’intero cristallo. Le cavità sono collegate da canali comunicanti tra loro e con l’esterno del cristallo, delimitati da aperture di diametro tale da consentire a cationi e molecole di migrare verso l’interno della struttura. Allo stato naturale le cavità e i canali sono occupati da ioni Na+, K+, Ca2+ (normalmente scambiabili) e molecole di acqua. I canali sono sufficientemente larghi da consentire il passaggio di specie ospiti.
Una delle caratteristiche di maggiore rilievo in termini funzionali è data dalla presenza dell’alluminio, che deriva dalla proprietà strutturale dei tectosilicati, e questa rende possibile la sostituzione dello ione coordinante il tetraedro, senza che si alterino le caratteristiche di omogeneità del reticolo cristallino, conferendo al minerale una notevole capacità di scambio cationionico a fronte di una elevata stabilità.
In natura sono state identificate circa 60 specie di minerali zeolitici, con rapporto Si/Al compreso, a parte rare eccezioni, tra 1 e 5, mentre le specie sintetiche risultano essere più di 200, con contenuto di Si molto variabile fino a termini completamente silicici.
Nelle fasi idrate la disidratazione si registra a temperature di solito inferiori a 400 °C ed è in larga parte reversibile.
La formula chimica è: (Me (m/z))・[Alm・Sin・O2(m+n)]・qH2O, con Me rappresenta un catione metallico estraneo alla struttura (Li+, Na+, K+,Ca2+, Sr2+, Ba2+, Mg2+, ecc.)
Rappresentazioni grafiche delle zeoliti
Applicazioni delle zeoliti
La disposizione spaziale della struttura genera una rete di cavità e di canali uniformi, intercomunicanti e di dimensioni comprese tra 0.3 e 1 nm. Questo determina nelle zeoliti estese superfici specifiche ed ampi volumi interni. Quest’ultimi sono occupati in condizioni normali dall’acqua o, previa rimozione di questa per trattamento termico, da molecole, specialmente polari, di diametro critico non maggiore delle finestre di accesso.
Da tali caratteristiche si possono desumere alcune proprietà delle zeoliti, da cui discendono molte interessanti applicazioni legate al settore agricolo, industriale ma anche per il settore legato alla salute della persona. Le più interessanti per i settori indicati:
- Adsorbimento
- Scambio ionico
Nel primo caso è possibile sfruttare la capacità di assorbimento dell’acqua di condensa.
Nel secondo, molto più interessante, deriva dalla loro capacità di scambio dei cationi ospiti dell’impalcatura anionica. Una volta poste a contatto con soluzioni esse sono infatti in grado di scambiare, in maniera più o meno completa, gli ioni del proprio reticolo con quelli presenti nella fase acquosa. Tale proprietà è determinata dal fatto che i cationi, presenti nei canali e nelle cavità per bilanciare la carica negativa del reticolo derivante dalla presenza di alluminio in coordinazione tetraedrica, sono legati piuttosto debolmente all’impalcatura anionica della zeolite.
I settori di interesse
Zeoliti per la produzione primaria
Funzione legata al sistema suolo-pianta (Nutrizione delle piante, chimica del terreno)
Le particolari proprietà chimico-fisiche delle zeoliti, sono alla base delle applicazioni nel settore agricolo. L’utilizzo è abbastanza recente, sebbene in alcune aree del Giappone è tradizione secolare utilizzare zeoliti naturali, quali clinoptilolite e mordenite, per il controllo del pH del suolo.
Ulteriori applicazioni legate agli aspetti nutrizionali delle piante, derivano dalla capacità della zeolite di fungere da agente a lento-rilascio nel suolo e di migliorare la ritenzione dei composti azotati e dei nutrienti in generale.
Lo scambio ionico ha un ruolo fondamentale in questo fenomeno: l’addizione di zeolite al suolo si traduce in un incremento della capacità di scambio nei confronti dei nutrienti, e in definitiva un miglioramento della fertilità del terreno. Infatti le zeoliti, principalmente quelle ricche di K+, una volta aggiunte al terreno, rilasciano il potassio lentamente e man mano che le piante lo richiedono. In modo del tutto analogo, tali molecole possono essere preventivamente “caricate” con composti azotati che saranno rilasciati lentamente, riducendo la dispersione nell’ambiente rendendo più efficiente l’assorbimento da parte delle colture. Inoltre, restando nel terreno, continueranno a svolgere funzione di “volano” per gli elementi nutritivi a carica positiva, continuando nel tempo a svolgere la loro funzione ambientale.
Negli ultimi anni ha destato grande interesse una particolare applicazione delle zeoliti nella preparazione di substrati artificiali per colture fuori suolo, denominate zeoponiche, termine usato per descrivere la coltivazione di piante in un suolo sintetico composto da zeolite e vermiculite, in cui i nutrienti vengono forniti alle piante con un bilanciamento nutrizionale senza perdite io sprechi.
Le zeoliti trovano inoltre utilizzo come coadiuvante nella difesa della coltura, mediante tre modalità di azione:
- produce un’azione disidratante sulla superficie di foglie e frutti, impedendo l’instaurarsi di un microclima idoneo allo sviluppo di patogeni fungini;
- la presenza del materiale svolge una discreta azione di protezione verso gli insetti, fornendo barriera protettiva ad azione meccanica sulle foglie e sui frutti;
- una azione corroborante (ovvero stimolante/potenziatore delle difese delle piante) dovuta alla struttura cristallina ben definita con un reticolo anionico che genera particolari campi elettrici in grado di stimolare le difese immunitarie e favorendo la cicatrizzazione delle lesioni sui rami, frutti e foglie, causate da fattori biotici ed abiotici.
Altro settore primario che trae vantaggio dalle zeoliti è l’acquacoltura. Utilizzate con buoni risultati per rimuovere l’ammonio che i pesci producono con la loro attività fisiologica, ma che ne compromette le funzioni vitali. In alcuni impianti pilota, la depurazione viene eseguita con uno scambio in colonna in modo tale che il ciclo di funzionamento del vivaio non subisca eventuali rallentamenti. La colonna, in genere di tufo clinoptilolitico, scambia i suoi cationi con lo ione ammonio, rigenerando così l’acqua senza che questa debba essere cambiata in continuazione, e quindi anche con dei vantaggi economici.
E’ poi interessato il settore zootecnico, sia per l’alimentazione che la gestione degli effluenti.
Per quanto concerne l’alimentazione, numerosi studi condotti in vari paesi, hanno dimostrato i benefici fisiologici delle zeoliti, naturali sugli animali. Con l’aggiunta di basse percentuali (5-6 %) di zeolite, come integratore minerale, alla razione viene registrato un incremento di peso ed una diminuzione dell’incidenza di malattie ed affezioni varie. In particolare è stato mostrato che: la clinoptilolite riduce la tossicità dell’ammonio e dell’urea negli animali assorbendo le compenti volatili azotate.
Inoltre, le zeoliti possono trovare impiego nella gestione degli effluenti, mediante “bagno” nei liquami con possibilità di caricare le frazioni organiche azotate per poi essere distribuite sul terreno. Questo consente una ridotta varca inquinane delle deiezioni animali residue dopo il trattamento con zeoliti e, nel contempo, la realizzazione di un concime azotato a lento rilascio.
Gli effetti fisiologici delle zeoliti naturali sono in relazione con la loro alta capacità di scambio e l’elevata selettività mostrata per le specie quali NH4+, Pb2+, Cd2+, Cu2+, Cs+ ed altri cationi che possono essere accumulati nei tessuti animali.
Zeoliti nella rimozione di inquinanti da acque di scarico
Negli ultimi decenni, col crescere della coscienza ecologica e con l’innalzamento delle soglie di attenzione ambientale, per quanto attiene le concentrazioni degli inquinanti nelle acque di scarico, molte delle tecniche di depurazione convenzionali sono risultate non più adatte. Da qui la necessità di studiare e mettere a punto processi specifici più efficaci. Tra questi nuovi processi, lo scambio cationico con zeoliti per l’abbattimento di cationi inquinanti presenti nelle acque ha assunto negli ultimi anni un ruolo di rilievo.
Negli anni ’50 sono iniziati gli studi sulle proprietà di scambio cationico delle zeoliti (Colella, 1996) che hanno poi condotto ad alcune applicazioni pratiche di tali minerali nel campo della tutela ambientale. Le zeoliti, con la loro struttura cristallina ben definita con un reticolo anionico che genera particolari campi elettrici, sono in grado di interagire con diverse tipologie di cationi. Da cui la possibilità di rimozione di cationi inquinanti da reflui.
Le attuali o potenziali applicazioni delle zeoliti come scambiatori cationici nel campo della depurazione delle acque riguardano essenzialmente:
– rimozione di NH4+ da acque di scarico urbane ed industriali;
– rimozione di metalli pesanti da acque di scarico industriali;
– rimozione di radionuclidi da acque di scarico di centrali nucleari.
Zeoliti nei detergenti
Le zeoliti hanno, da circa vent’anni, sostituito, nella composizione dei detergenti i polifosfati (essenzialmente il tripolifosfato di sodio) ritenuti responsabili di un elevato degrado ambientale, ed in particolare del fenomeno che va sotto il nome di eutrofizzazione. Tale fenomeno produce una crescita abnorme di alghe in ambienti lacustri e marini, che provocano una riduzione del ricambio di ossigeno nell’acqua e la conseguente morte della fauna marina.
La funzione dei polifosfati era quella di migliorare l’efficacia del detersivo rimuovendo i cationi Ca 2+ e Mg 2+ dall’acqua di lavaggio, per prevenirne la precipitazione ad opera dei tensioattivi, e quindi l’usura delle parti meccaniche delle lavatrici.
L’uso delle zeoliti fu suggerito negli anni ’70, dopo che numerosi studi ne avevano dimostrato sia la validità nel raddolcire l’acqua in fase di lavaggio, sia la non tossicità per la salute dell’uomo e per l’ambiente in generale.
Zeoliti e benessere della persona
In alcune circostanze, con specifici obiettivi, è possibile attivare la zeolite (il caso più diffuso sembra quello della Clinoptilolite, in virtù della sua forte capacità di scambio cationico. Ciò rende la zeolite un dispositivo medico con funzioni adiuvanti in alcune terapie o come na sostanza sia detossificante che antiossidante.
Per attivazione si intende l’applicazione di un procedimento volto a incrementarne la porosità o di aumentarne la superficie attraverso la diminuzione delle dimensioni delle particelle.
Ciò consente di avere a disposizione un maggior numero di canali capaci di legare le sostanze tossiche. Il risultato è l’aumento del numero di particelle con dimensioni ridotte, un incremento della loro superficie ed un’attivazione strutturale che consente loro di legare più velocemente e più stabilmente tossine, radicali e metalli, incrementandone l’attività. Infatti, partendo da una dimensione di circa 3 m2/g di zeolite, dopo l’attivazione si raggiungono persino i 1000 m2/g.
Le caratteristiche peculiari della zeolite clinoptilolite attivata sono costituite dalla capacità di legare, a livello intestinale, radicali liberi, metalli pesanti, ione ammonio e tossine, allontanandole dall’organismo, attività descritte nella definizione stilata dal Nomenclatore Europeo dei dispositivi medici.
Materiali di silice naturali, compresi la zeolite clinoptilotite, rivelano molteplici attività biologiche, e sono già impiegate con successo come adiuvante in diverse terapie portato ad un miglioramento dello stato di salute generale.
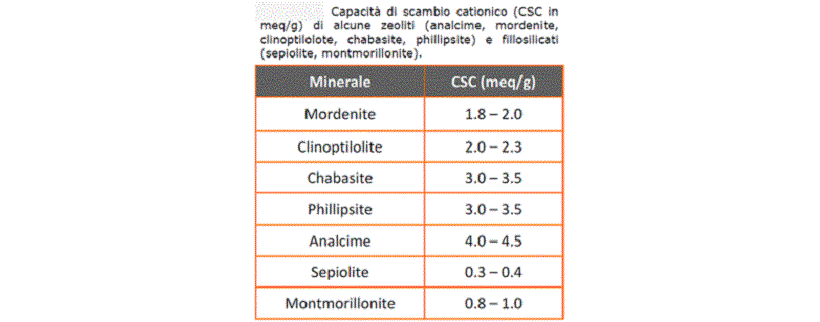
Tabella 1: Capacità di scambio cationico di diversi tipi di zeoliti
Bibliografia e sitografia:
Anaclelio S. Produzione di ceramici avanzati con tecnologie non convenzionali. dottorato di ricerca in ingegneria dei materiali e delle strutture. Tesi di Dottorato in ingegneria dei materiali e delle strutture. Universitá degli Studi di Napoli Federico II. Facoltà di Ingegneria.12/11/2009
http://www.agribionotizie.it/la-zeolite/
https://www.chimicamo.org/chimica-generale/zeoliti.html
http://www.chimdocet.it/solido/file11c.htm
Donato Ferrucci, Dottore agronomo libero professionista, riveste attualmente l’incarico di Responsabile di Bioagricert Lazio e di Cultore della materia presso la cattedra di Gestione e Comunicazione d’Impresa” – Facoltà di Scienze della Comunicazione, Università degli Studi della Tuscia. E-mail: donatoferrucci@alice.it