Il deperimento del frassino in Italia da Chalara f.
di Luca Poli
Inquadramento di Fraxinus L.
Il genere Fraxinus comprende una sessantina di specie arboree diffuse soprattutto nelle regioni temperate e subtropicali dell’emisfero settentrionale ma anche nelle regioni boreali o ai tropici.
I frassini sono aggregati in 2 sezioni a seconda se l’antesi avviene prima o dopo la fogliazione: sezione Ornus (Neck.) DC, con fioritura al termine della distensione del ramo dell’anno, a cui appartiene F. ornus; sezione Fraxinaster DC., con fioritura antecedente la germogliazione, alla quale appartengono F. excelsior e F. angustifolia.
Facendo riferimento a F.excelsior in quanto è la specie principalmente interessata dal deperimento, è definibile come una pianta a rapido accrescimento e abbastanza longeva, con tronco dritto e slanciato e chioma poco ramosa e leggera, dapprima ovale e poi arrotondata. La corteccia, inizialmente liscia e verde olivastra, diviene tardivamente grigio-bruna, finemente e densamente fessurata con ritidoma persistente; i rami dell’anno sono robusti, lisci, di colore verde-grigio, con lenticelle visibili; le gemme sono nere e vellutate. Le piante possono essere ermafrodite, poligame o unisessuali. L’apparato radicale è molto sviluppato e può scendere in profondità tramite il fittone e le numerose radici laterali verticali. Il legno, bianco giallastro e poco differenziato, è molto duro, pesante, tenace ed elastico; è ricercato per mobili pregiati. (Gellini e Grossoni, 1997).
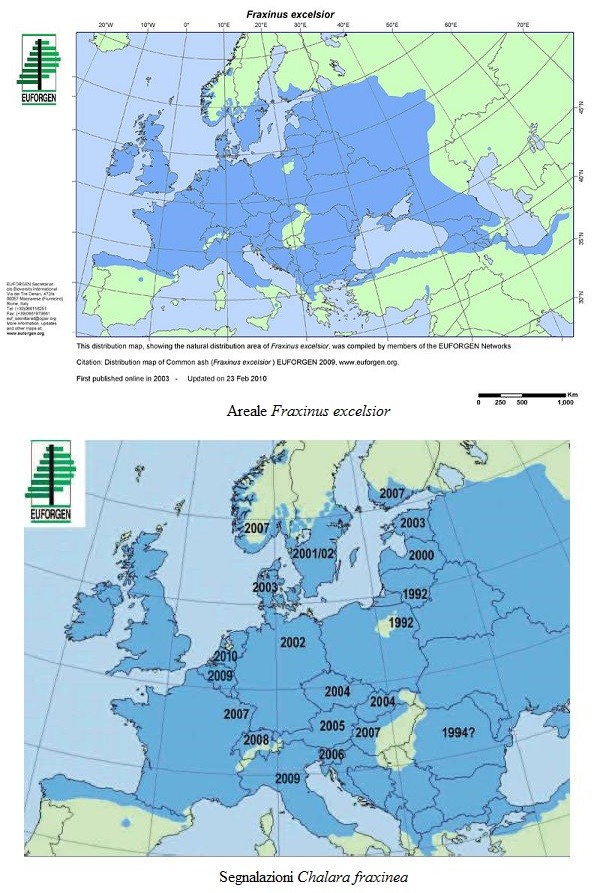
L’areale del frassino maggiore è piuttosto simile a quello dell’acero riccio ma si espande maggiormente verso ovest arrivando fino all’Atlantico, mentre ad est è diffuso fino al grado 60 di latitudine.
E’ specie eliofila ma tollera l’ombra finchè giovane; è sensibile alle gelate tardive ma è molto resistente alle basse temperature se è in dormienza. Vuole terreni fertili, poco coerenti, alcalini, neutri o anche subacidi; tollera i suoli limosi o moderatamente argillosi; negli ex coltivi assume carattere invasivo. Ha come fattore limitante l’acqua, che deve essere abbondante; sopporta bene anche un mese di sommersione delle radici.
Gli agenti fungini responsabili del deperimento del frassino sono Chalara fraxinea Kowalski per la forma anamorfica e Hymenoscyphus pseudoalbidus Queloz. per la forma teleomorfica.
Le piante colpite da questa patologia appartengono al genere Fraxinus: in particolare è stato riscontrato su F. excelsior, sia in infezioni naturali che artificiali, con risultati positivi anche ai postulati di Kochs, evidenziandone l’associazione a sintomi fogliari. Per F. angustifolia i danni da infezione naturale sulle foglie restano ancora da indagare; F. ornus, pur avendo mostrato una certa suscettibilità agli esperimenti di inoculazione sulla foglia, non può essere considerato un ospite naturale di H.pseudoalbidus (Kräutler et al.,2012).
In ambito europeo, le prime segnalazioni di Chalara fraxinea risalgono agli inizi degli anni ’90 nella zona tra Polonia e Bielorussia; sovrapponendo la carta dell’areale del Fraxinus excelsior con quella delle date delle segnalazioni del patogeno nei diversi paesi europei, è possibile ricostruirne il tracciato d’espansione, che tende a coprire tutto l’areale della pianta. Ad oggi è presente in 22 paesi europei.
Sintomatologia
La malattia è caratterizzata da un vasto range di sintomi: oltre a lesioni necrotiche della corteccia e del cambio con decolorazione del legno, che portano al deperimento dei germogli, si riscontrano dei sintomi anche sulle foglie che includono lesioni necrotiche su piccioli e nervature.
Infezioni reiterate sullo stesso soggetto provocano il progressivo disseccamento della ramificazione secondaria e terziaria, facendo assumere un aspetto rado e sofferente alla chioma, indice dell’inizio del deperimento della pianta intera. Gli alberi colpiti mostrano numerosi rami epicormici.

Figura 1. Sintomi fogliari su F. excelsior comunemente visti a partire dalla fine dell’estate in collegamento al deperimento del frassino: (A) lesione necrotica su rachide fogliare, (B) Vista dettagliata di una lesione necrotica su un rachide, (C) Lesione necrotica della venatura fogliare che si estende al rachide.
Strategie di lotta
La presenza di questa patologia genera forte preoccupazione anche perché non esistono al momento metodi di lotta efficaci. Si dovranno quindi tenere particolari precauzioni nella movimentazione di materiale vegetale valutandone attentamente la positività alla presenza del fungo, oltre che promuovere ulteriori studi sull’eziologia, la distribuzione geografica e l’impatto economico del deperimento del frassino.
Kowalski e Holdenrieder (2008) ritengono che sia necessario monitorare i vivai ed impedire la diffusione di piante infette, almeno a livello europeo.
Il rilevamento di C. fraxinea in vivai forestali, può suggerire che l’utilizzo di piante da semina malate può accelerare la diffusione di questo patogeno (Kirisits et al., 2010). In ambito di vivaio sono in via di sperimentazione (DEFRA, GB) trattamenti chimici con diversi principi attivi.
Da maggio 2012, per la durata prevista di 4 anni, inoltre è stato attivato FRAXBACK, un progetto europeo del European Cooperation in Science and Technology (COST) e supportato da EU RTD Framework Programme. Il gruppo di lavoro è composto da patologi forestali, genetisti, selvicoltori e produttori, rappresentanti di molti Paesi europei.
Da segnalare positivamente come anche in Italia stia iniziando, presso autonomi enti locali, un’attenzione particolare al patogeno: si fa riferimento alla Regione Lazio che con nota prot. 105233/DA/10/25 del 18/03/2013, ha diffuso l’allerta sulla possibile presenza dell’agente che causa il deperimento del frassino, obbligando a segnalarne il ritrovamento al Servizio Fitosanitario Regionale.
Interazioni ambiente-patogeno-ospite
Si intende riportare in questo paragrafo alcune considerazioni riguardanti le possibili interazioni tra ambiente, patogeno ed ospite, tratte da diversi autori, che potrebbero risultare utili ai fini della previsione dello sviluppo di tale malattia in Europa, con riferimento anche a plausibili strategie di lotta. Vengono proposte inoltre delle considerazioni riguardo lo sviluppo del deperimento del frassino nel nostro Paese.
In un articolo pubblicato nel 2011, gli autori McKinney et al. descrivono uno studio effettuato in Danimarca sulla suscettibilità di 39 diversi cloni da talea di F. excelsior a C. fraxinea. In questo Paese i primi sintomi sono stati osservati nel 2003 ed il patogeno è diventato comune dal 2005; le osservazioni sulla risposta al patogeno delle piante sono iniziate nel 2007 ed hanno proseguito per tre anni. Le prove in campo hanno riguardato lo studio di 50 rametti per ognuno dei 39 alberi scelti, in 14 diverse stazioni danesi.
I risultati mostrano una forte variabilità nella suscettibilità al patogeno delle diverse popolazioni di F. excelsior danesi; la presenza di variazione genetica naturale apre prospettive di adattamento della specie al patogeno attraverso la selezione di alberi con maggiore idoneità (“fitness”) alla resistenza parziale osservata nello studio.
Sono stati già avviati studi in campo utilizzando cloni inclusi in questo studio; le inoculazioni controllate sono indicate per chiarire se la variazione nella suscettibilità è causata da caratteri fenologici o meccanismi di resistenza o da una combinazione di entrambi.
In questa fase è difficile dedurre l’esito di tale scenario di selezione naturale, perché la dinamica dipenderà dalla co-evoluzione tra ospite e patogeno, e dalla durabilità della resistenza (Salvaudon et al., 2008). A tale proposito, è probabile che le popolazioni di Fraxinus sp. italiane possiedano una maggiore variabilità genetica, come evidenziato per molte altre piante già oggetto di studi simili, in quanto la Penisola è stata area rifugio per la maggior parte delle specie forestali durante l’ultima glaciazione (Würm). Questo fatto potrebbe quindi far pensare ad una migliore capacità di risposta alla malattia delle popolazioni italiane di frassino.
In Italia, dopo le prime segnalazioni in Friuli lungo il confine sloveno nel 2009, il patogeno si è velocemente espanso in Veneto e Trentino-Alto Adige, secondo una direttrice NE-SO, che segue la dorsale alpina ed i rilievi delle Prealpi.
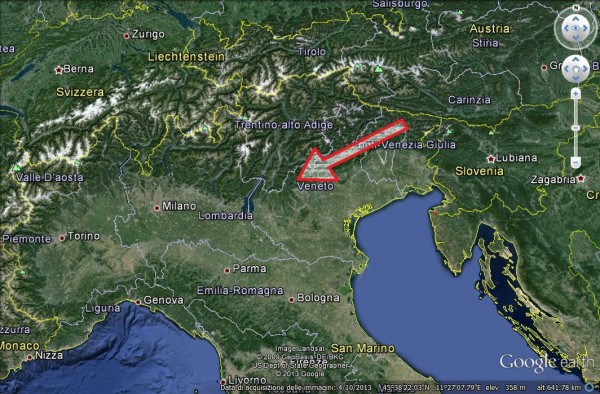
E’ ipotizzabile che, a causa della barriera fisica costituita dalla dorsale Alpina, il patogeno abbia trovato più facile via d’ingresso nel NE dell’Italia, appunto dalla Slovenia, dove la morfologia del territorio può averne favorito la diffusione naturale. Kowalski e Holdenrieder (2009) affermano infatti che la forma teleomorfa Hymenoscyphus albidus, contrariamente a quanto avviene per le conidiospore di C. fraxinea, dissemina le proprie ascospore con meccanismo anemocoro.
Dai rilievi effettuati da Ogris N. et al. nel 2009, durante i primi riscontri di C. fraxinea in Italia, emerge che, anche in senso altitudinale, il patogeno si manifesta molto ubiquitario: nella tesi di laurea di Floreancig, dalla quale è poi stato fatto l’articolo citato, si riporta che nonostante i ricercatori pensassero inizialmente di ritrovare il fungo quasi esclusivamente nei fondovalle e a quote basse, nei rilievi effettuati sono stati riscontrati attacchi anche a quote di 1000 m s.l.m. (Monte Matajur), su piante isolate.
A livello stazionale l’intensità del deperimento è maggiore vicino ai corsi d’acqua, ovvero dove l’umidità del terreno e dell’aria è maggiore, dove le temperature sono inferiori alla media e dove si ha una minor presenza di luce diretta (Ogris, 2008); generalmente le caratteristiche riscontrabili negli impluvi.
Nel corso di uno studio condotto da Cech nel 2008 è emerso che la sottomissione a livello di singole piante e la mancanza di diradamenti a livello di popolamento sono tra i fattori amplificanti l’intensità degli attacchi, così come risultano maggiormente colpiti gli individui unisessuali femminili e quelli ermafroditi rispetto a quelli maschili.
Vista la predisposizione del patogeno ad attaccare sia la rinnovazione che alberi adulti, è possibile ipotizzare una progressiva diminuzione del numero di individui di frassino, in maniera rilevante e relativamente in breve tempo. In un prossimo futuro è necessario quindi un continuo rilievo e monitoraggio dell’andamento della malattia nel nostro Paese, dato anche che è molto plausibile che continui la sua espansione almeno nel resto del Nord-Italia. Uno studio interessante potrebbe riguardare il possibile impatto sulle popolazioni di F. excelsior maggiormente a sud, ovvero quelle dell’Italia centrale.
Nell’ottica della gestione degli ecosistemi forestali, invece, sarà possibile evidenziarne gli eventuali esiti negativi e trovare adeguate pratiche selvicolturali per la gestione dei soprassuoli colpiti (es. diradamenti, ceduazione delle piante colpite).
Bibliografia
- Cech T., (2008). Eschenkrankenheit in Niederösterreich – Neue Untersuchungsergebnisse. Fortstschutz Aktuell 24-28.
- Conedera M., Engesser L., Maresi G., (2012). Chalara fraxinea, Agricoltore Ticinese, anno 144, numero 39, 28 settembre, pag. 10.
- Floreacig V., (2009). Presenza di Chalara fraxinea Kowalski lungo il confine italo-sloveno, Tesi di laurea in Tecnologie forestali ed ambientali, Università degli Studi di Padova.
- Gellini R., Grossini P., 1997. Botanica Forestale, Vol.II Angiosperme, pag. 327-334.
- Kirisits T., Matlakova M., Mottinger-Kroupa S., Halmschlager E., Institute of Forest Entomology, Forest Pathology and Forest Protection (IFFF), Department of Forest and Soil Sciences, University of Natural Resources and Applied Life Sciences, Vienna (BOKU), Hasenauerstrasse 38, A-1190 Vienna, Austria; Lakatos F., Institute of Silviculture and Forest Protection, University of West Hungary, Sopron, Ady E. str. 5, H-9400 Sopron, Hungary, (2010). Chalara fraxinea associated with dieback of narrow-leafed ash (Fraxinus angustifolia), Plant Pathology 59, 411.
- Kowalski T., Agricultural University Kraków (Poland), Holdenrieder O., Institut für Integrative Biologie, ETH Zürich (CH) (2008). A new fungal disease of ash in Europe, Schweizerische Zeitschrift fur Forstwesen: March 2008, Vol. 159, No. 3, pp. 45-50.
- Kowalski T., Holdenrieder O., (2009). The teleomorph of Chalara fraxinea, the causal agent of ash dieback, Journal compilation Blackwell Verlag.
- Kräutler K., Kirisits T., Institute of Forest Entomology, Forest Pathology and Forest Protection (IFFF), Department of Forest and Soil Sciences,University of Natural Resources and Life Sciences, Vienna (BOKU), Hasenauerstraße 38, A-1190 Vienna, Austria. (2012). The ash dieback pathogen Hymenoscyphus pseudoalbidus is associated with leaf symptoms onash species (Fraxinus spp.), Journal of Agricultural Extension and Rural Development Vol. 4(9), pp. 261-265.
- Moriondo F., Capretti P., Ragazzi A., (2006). Malattie delle piante in bosco, in vivaio e delle alberature, Pàtron Editore, Bologna.
- Ogris N., (2008). Jesenov ožig, Chalara fraxinea. Novice iz Varstva Gozdov 1, 1 (in Slovenian).
- Ogris N., Hauptman T., Jurc D, Slovenian Forestry Institute, Večna pot 2, 1000 Ljubljana, Slovenia; Floreancig V., Marsich F., Montecchio L., Università degli Studi di Padova, Dipartimento Territorio e Sistemi Agro-Forestali, viale dell’Università 16, I-35020 Legnaro, Italy, (2010). First Report of Chalara fraxinea on Common Ash in Italy, APS Journal.
- McKinney LV, Nielsen LR, Hansen JK and Kjær ED, Department of Forest Genetic Resources, Forest and Landscape Denmark, Faculty of Life Sciences, University of Copenhagen, Frederiksberg, Denmark, (2011). Presence of natural genetic resistance in Fraxinus excelsior (Oleraceae) to Chalara fraxinea (Ascomycota): an emerging infectious disease, Heredity 106, 788–797.
- Salvaudon L, Giraud T, Shykoff JA (2008). Genetic diversity in natural populations: a fundamental component of plant–microbe interactions. Curr Opin Plant Biol 11: 135–143.
Sitografia
- EPPO, European and Mediterranean Plant Protection Organization, URL: www.eppo.it [data di accesso: Luglio 2013].
- EUFORGEN, European Forest Genetic Resources Programme, URL: http://www.euforgen.org/ [data di accesso: Luglio 2013].
- FitForest, schede dei principali parassiti forestali, URL: http://www.unipd.it/esterni/wwwfitfo/parassiti.htm [data di accesso: Luglio 2013].
- Forestry Commission of Great Britain per scheda Chalara dieback of ash, URL: www.forestry.gov.uk/chalara [data di accesso: Luglio 2013].
- FRAXBACK, Fraxinus future, guidelines and strategies, URL: www.fraxback.eu [data di accesso: Luglio 2013].
- Piattaforma E-Learning diagnostica Forest@le, URL: http://forestale.agraria.org/ [data di accesso: Luglio 2013].
- RomaNatura – Ente Regionale per la Gestione del Sistema delle Aree Naturali Protette nel Comune di Roma, Informativa su Chalara fraxinea. URL: http://romanatura.roma.it/agente-del-deperimento-del-frassino-chalara-fraxinea/ [data di accesso: Luglio 2013].
Luca Poli, diplomato all’Istituto tecnico agrario, ha conseguito la laurea triennale in Scienze forestali ed ambientali presso l’Università degli Studi di Firenze. E’ iscritto al secondo anno del corso di laurea magistrale in Scienze e tecnologie dei sistemi forestali. Curriculum vitae >>>
 |
Atlante di selvicoltura Una vera enciclopedia sulla selvicoltura. Le specie vegetali ed animali trattate sono più di 800… |