Batteri fitopatogeni e batteriosi (1^ Parte)
di Antonio Mazzucchi
Introduzione
I batteri sono organismi procarioti, unicellulari, mancanti di nucleo, cloroplasti, mitocondri, vacuoli e di reticolo endoplasmatico, moltiplicantisi per schizogonia, costituiti da parete, membrana citoplasmatica, citoplasma e cromosoma. Il possesso di una parete distingue i batteri dai fitoplasmi, altra classe di procarioti. Hanno i caratteri ereditari codificati nel cromosoma o in plasmidi eventualmente presenti, circa 10-100 volte più piccoli rispetto al cromosoma. Entrambi sono molecole anulari di DNA a doppia catena, non racchiusi da membrane. Al cromosoma sono associate proteine che distinguono domini genomici. Nel citoplasma è distribuito a reticolo un citoscheletro proteico.
Malattie delle piante causate da batteri sono note fin dalla fine dell’ottocento. In Italia, il primo a dimostrare eziologia batterica di una malattia delle piante fu Savastano con i suoi studi originali (1886-1889) sulla rogna dell’olivo. Pur essendo segnalate in Italia su numerose piante agrarie, occasionalmente anche in forma epidemica, le batteriosi condizionano la produzione solo in poche colture erbacee (es. fagiolo, patata, pomodoro, sedano, garofano) ed arboree (pomacee, drupacee, nocciolo, actinidia, olivo, vite), sia in pieno campo che in ambiente controllato (Tabella 1). E’ incombente il rischio di introdurre certe batteriosi (es. cancro e inverdimento degli agrumi, malattia di Pierce della vite) potenzialmente capaci di arrecare gravi danni. Negli anni novanta del secolo scorso sono comparse in Italia il colpo di fuoco delle pomacee e il marciume bruno della patata; mentre il colpo di fuoco si va tuttora diffondendo, del marciume bruno non c’è stata apparentemente diffusione almeno nelle colture industriali. Le batteriosi rivestono particolare importanza per le produzioni vivaistiche, sementiere e micropropagative.
I batteri fitopatogeni sono eterotrofi, a forma di bastoncello, misuranti 0.6-3,5 µm di lunghezza e 0,5-1 µm di larghezza. In ambiente naturale si presentano singoli od aggregati in corte catenelle od in gruppi caratteristici (es. a stella, ad Y, a V). Quelli mobili nuotano per mezzo di lunghi filamenti, detti flagelli, inseriti ad una estremità (polari) o tutto attorno alla parete (peritrichi). L’intervallo termico ottimale di crescita è compreso tra 25 e 30°C (psicrofili) e non sempre corrisponde a quello ottimale per causare malattia. Per moltiplicarsi necessitano di adeguata nutrizione minerale ed organica, che in natura trovano vivendo in associazione con le piante nella rizosfera,nella fillosfera o al loro interno. In laboratorio possono essere coltivati su appropriati mezzi nutritivi, solidi o liquidi. Una minoranza di specie scoperte a partire dal 1972, detti batteri fastidiosi, hanno spiccate esigenze nutrizionali e il loro allevamento in laboratorio è assai difficile (es. Xylella) o impossibile (es. Phlomobacter).
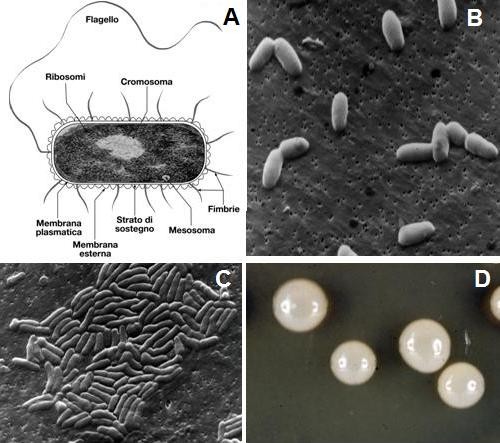
Fig. 1 – Rappresentazione schematica di una cellula batterica Gram-negativa (A); singoli batteri Gram-positivi al microscopio elettronico a scansione (B); microcolonia di batteri al microscopio elettronico a scansione (C); macrocolonie a cupola di batteri cresciute su agar nutritivo in laboratorio (D).
Tassonomia
I batteri fitopatogeni, appartenenti alle divisioni Gracilicutes e Firmicutes del regno Procaryotae, comprendono specie Gram-negative e Gram-positive.
Ci sono 26 generi di batteri fitopatogeni (escludendo i sinonimi Pectobacterium e Rhizobium) tradizionali e 3 generi di batteri fastidiosi (Xylella, Liberobacter, Phlomobacter) per un totale di 108 specie ufficialmente riconosciute.
Di seguito l’elenco dei generi con il numero delle relative specie in parentesi:
Acidovorax (4), Agrobacterium (5), Arthrobacter (1), Brenneria (6), Clavibacter (3), Curtobacterium (1), Dickeya (6), Enterobacter (4), Erwinia (22 ), Herbaspirillum (1), Janthinobacterium agaricidamnosum (1), Leifsonia (1), Liberobacter (2), Nocardia (1), Pantoea (5), Pectobacterium (sinonimi Erwinia del marciume molle), Phlomobacter (1), Pseudomonas (27), Ralstonia (2), Rathayibacter (3), Rhizobacter (1), Rhizobium (sinonimi con Agrobacterium), Rhizomonas (1), Rhodococcus (1), Samsonia (1), Serratia (1), Sphingomonas (2), Xanthomonas (21), Xylella (1), Xylophilus (1).
Per identificare le specie dei batteri fitopatogeni oltre alla normale denominazione binaria sono usate denominazioni ternarie e quaternarie aventi importante significato fitopatologico.
Entro certe specie sono stati descritte le patovar (abbreviate pv.), ovvero varietà patogenetiche, distinguibili tra loro per la specificità della specie vegetale ospite: membri di una stessa patovar condividono la capacità di infettare la stessa specie vegetale od una stessa gamma (per lo più ristretta) di specie vegetali ospiti,spesso tassonomicamente vicine; d’altra parte, patovar distinte di una stessa specie batterica infettano specie vegetali differenti (es. P. syringae pv. tomato infetta il pomodoro, P. syringae pv. phaseolicola il fagiolo) ed infezioni incrociate, di regola, non sono possibili. Le specie più importanti suddivise in patovar sono: Pseudomonas syringae (con 64 pv.), Xanthomonas campestris (58 pv.), Xanthomonas axonopodis (47pv.), Xanthomonas arboricola (7pv.), E. chrysanthemi (6), Curtobacterium flaccumfaciens (5).
Altre specie sono suddivise in sottospecie (abbreviato: subsp.): popolazioni omogenee della stessa specie batterica distinguibili per certi caratteri biochimici e patogenetici. Le specie suddivise in sottospecie sono: Erwinia carotovora (sinonimo Pectobacterium carotovorum) (6 subsp.), Clavibacter michiganensis (5 subsp.), Xylella fastidiosa (3 subsp.), Leifsonia xyli (2 subsp.), Pantoea stewartii (2 subsp.).
Nell’ambito delle patovar possono distinguersi le razze, popolazioni di una stessa patovar capaci di attaccare certe cultivar e non altre di una specie vegetale. Per la denominazione delle razze è usata la denominazione quaternaria: es. Pseudomons syringae pv. glycinea, razza 1. La serie delle cultivar (o varietà) usata per definire le razze è detta differenziale. Ogni razza di una patovar possiede uno o più geni di avirulenza (geni Avr) corrispondenti ad altrettanti geni di resistenza (R) nelle cultivar differenziali.
La denominazione di razza è usata con significato diverso per la specie Ralstonia solanacearum ad indicare popolazioni capaci di infettare specie vegetali differenti: razza 1 su ampia gamma di specie ospiti; razza 2 su banani; razza 3 su patata e pomodoro; razza 4 su zenzero; razza 5 su gelso.
Tre membri del genere Liberobacter e uno del genere Phlomobacter, non coltivabili in laboratorio, sono allo stato di Candidatus perché non è stato ancora possibile definire l’insieme dei caratteri fenotipici e genetici necessari per attribuire loro lo stato ufficiale di specie.
Patogenesi
Associati alle piante, i batteri fitopatogeni possono essere epifiti o endofiti. Allo stato epifita vivono nel film liquidi dove si accumulano gli essudati delle piante, nella rizosfera e nella fillosfera. Allo stato endofita colonizzano gli spazi intercellulari dei tessuti e/o gli elementi conduttori (tracheidi e vasi) dello xilema (habitat apoplastico). Una minoranza alberga nei tubi cribrosi del floema (habitat simplastico). Di regola, la patogenicità è espressa solo allo stato endofita; lo stato epifita è noto solo per una parte di essi.
I batteri non sono in grado di superare attivamente (per azione meccanica od enzimatica) le pareti cutinizzate, suberificate e/o lignificate dei tessuti tegumentali. Il passaggio ad endofiti è sempre passivo ed ha luogo in punti dove le barriere sono naturalmente (stigmi, nettarii, stomi, idatodi e lenticelle) od occasionalmente (micro- e macroferite di qualsiasi natura) interrotte. La penetrazione ha luogo di norma in condizioni di bagnatura delle sedi e, per stomi ed idatodi, è associata ad uno stato di congestione idrica dei tessuti. La congestione ha luogo quando a cellule vegetali turgide c’è eccesso di acqua nelle pareti e nello xilema in modo che le camere ipostomatiche si riempiano di liquido e negli idatodi si creino condizioni per la guttazione. L’evento avviene di regola durante la stagione vegetativa con terreno caldo e umido alle prime luci dell’alba in presenza di rugiada.
Poche ore dopo la penetrazione, i batteri iniziano a moltiplicarsi ed a colonizzare i tessuti solo se hanno la capacità di prevenire, evitare o superare le reazioni di difesa messe in atto dalla pianta. Le prime 2-3 ore sono critiche per il successo delle infezioni. Penetrati ed entrati in contatto con le pareti delle cellule vegetali i batteri virulenti hanno la capacità di produrre sistemi di secrezione che liberano nell’ambiente o addirittura iniettano fattori di virulenza entro le cellule della pianta ospite. I fattori di virulenza interferiscono, sabotano o distruggono i sistemi di segnalazione posseduti dalle cellule vegetali per mettere in atto le barriere di difesa.
Divenuti endofiti possono avere attitudini biotrofiche o necrotrofiche; quelli biotrofici riescono a convivere temporaneamente con le cellule vegetali senza arrecare danni irreversibili, si nutrono di soluti apoplastici resi disponibili dalle cellule vegetali sotto l’effetto dei fattori di virulenza; quelli necrotrofici, invece, uccidono a distanza (qualche decina di µm) le cellule vegetali servendosi di propri enzimi degradativi extracellulari e si nutrono di soluti resi liberi dalla degradazione dei polimeri delle pareti vegetali e/o dalle cellule moribonde. La morte ipersensitiva delle cellule vegetali, alla cui parete si sono attaccati batteri, è la reazione battericida più rapida, bloccante i batteri biotrofici negli stessi punti di penetrazione.
La progressiva infezione dei tessuti porta alla comparsa di sintomi, correlati per qualità ed evoluzione al tipo di habitat endofita. Batteri a prevalente habitat intercellulare sono agenti di maculature, macchiettature e marciumi molli in foglie, frutti, tuberi e bulbi, di cancri nei tessuti corticali degli alberi. Batteri a prevalente habitat xilematico sono agenti di appassimenti e di avvizzimenti, ed anche di cancri in piante erbacee. Per gli agenti di iperplasie (tumori, galle) prevale l’habitat intercellulare. Di regola, però, ogni batterio fitopatogeno può avere entrambi gli habitat. Gli spostamenti endofiti a distanza dalle lesioni primarie hanno luogo di norma per via xilematica. Il passaggio tra due elementi xilematici successivi avviene attraverso punteggiature, per distruzione meccanica od enzimatica dei tramezzi.
Il periodo di incubazione delle batteriosi è variabile da un minimo di due giorni per i marciumi molli, a circa 3-7 giorni per le maculature delle foglie e dei frutti, a 15-20 giorni per le galle ed i tumori, sino ad un massimo di 6 mesi e ad oltre un anno per certe infezioni vascolari. Le maculature fogliari, dette maculature angolari, osservate in fase iniziale, sono il sintomo di maggior valore diagnostico per la loro peculiarità: aree di 2-4 mm di diametro, di color verde oliva, idropiche (il tessuto pare pieno d’acqua), a bordo poligonale, contornate dalle nervature più piccole.
Le reazioni post-infezionali in grado di contenere od arrestare la colonizzazione sia dei biotrofici che dei necrotrofici, consistono per lo più nella attuazione di barriere di suberina e/o di lignina associate alle pareti nei tessuti parenchimatici, cementazione delle punteggiature, versamenti di gomme e tillosi negli elementi xilematici.
I batteri possono evadere dai tessuti infetti sotto forma di essudato, criptico o palese, costituito da milioni di cellule confettate in polisaccaridi idrofili da essi stessi prodotti. L’essudato criptico forma una sottile pellicola superficiale e si rende visibile per l’aspetto untuoso o lucente della area infettata. L’essudato palese è visibile sotto forma di gocciole lattiginose o giallastre. Certi batteri non hanno mai evasione sotto forma di essudato e la loro fuoriuscita dalla pianta ospite è passiva a seguito di degradazione dei residui della vegetazione infetta o per azione di fitofagi.
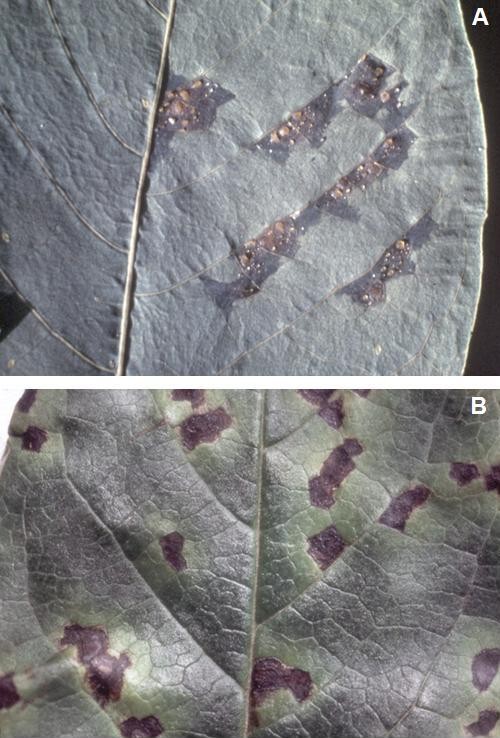
Fig. 2a – Tipiche maculature angolari su foglie causate da infezioni batteriche (A, B). Stato idropico (A) e necrotico (B).

Fig. 2b – Maculature su pesca causate da X. arboricola pv. pruni (A). Maculature su baccello di fagiolo causate da Pseudomonas syringae pv. phaseolicola (B). Su alcune maculature sono visibili gocciole di essudato biancastro.
Epidemiologia
Le batteriosi sono malattie infettive aventi sorgenti di inoculo primarie e secondarie. Le sorgenti primarie danno origine ai batteri causanti la prima infezione all’inizio del periodo vegetativo, quelle secondarie ai batteri responsabili delle infezioni successive. Le sorgenti primarie più comuni sono i residui della vegetazione infetta, semente ed organi di propagazione vegetativa per le piante erbacee, gemme, marze, talee, barbatelle, portainnesti, astoni e cancri corticali per gli alberi. Semi ed organi di propagazione vegetativa spesso albergano batteri in modo asintomatico. L’efficacia dei residui della vegetazione infetta come sorgente di inoculo di regola non va oltre la completa decomposizione ad opera della microflora terricola. Residui lignificati, pertanto, sono sorgenti più durevoli rispetto a quelli erbacei. Nei semi, i batteri possono essere meri contaminanti superficiali oppure essere interni infettando più frequentemente il tegumento, i cotiledoni, l’endosperma, raramente l’embrione; in certi casi possono essere associati alla materia inerte della semente come residui di pianta madre o particelle di terreno mescolate ai semi durante la trebbiatura. I batteri seminali, comunque, sono in stato di ipobiosi, meno sensibili ai trattamenti termici ed alla disidratazione. Tuberi, bulbi, talee, marze e barbatelle, albergano più frequentemente i batteri entro lo xilema dei tessuti vascolari. Nelle gemme i batteri si localizzano tra le perule e/o nello scudetto perigemmario entro le tracce fogliari od il parenchima sotto la cicatrice di caduta delle foglie; nei cancri corticali ibernanti di tronchi e branche possono sopravvivere al margine in qualche areola di tessuto infetto.
Sorgenti secondarie di inoculo sono gli stessi organi infettati nel corso del periodo vegetativo.
Dalle sorgenti di inoculo i batteri sono disseminati da vettori abiotici e biotici. Agenti di disseminazione più comuni sono acqua, vento, insetti, nematodi, uccelli e uomo. Le gocce d’acqua colpendo le sorgenti di inoculo si frangono, sospendono i batteri disponibili e generano aerosol infettivi liquidi. Le minuscole gocciole di sospensione possono schizzare direttamente fino a circa 1-2 metri od essere trasportate dal vento su organi della stessa pianta, di piante attigue o di piante site ad una distanza non superiore a 500-1000 metri. Il vento può disseminare anche aerosol infettivi solidi generati in colture infette nel corso della trebbiatura o di altre operazioni colturali polverizzanti tessuti infetti oppure dalla frammentazione delle crosticine generatesi su organi infetti a seguito del disseccamento delle gocciole evase di essudato.
Gli insetti contraggono rapporti di trasmissione assimilabili più spesso al tipo virale non persistente. Si contaminano l’apparato boccale o gli arti o altre appendici nutrendosi su una pianta malata, e poi trasportano i batteri su una pianta sana. In pochi casi la trasmissione è assimilabile al tipo propagativo. Chaetocnema pulicaria, l’altica del mais, può albergare vitale nel proprio intestino E. stewartii per tutto l’inverno e trasmetterlo alle giovani piante di mais alla prima infestazione della primavera seguente. Analoga trasmissione ha E. tracheiphila, agente dell’avvizzimento delle cucurbitacee, per mezzo dei coleotteri Acalymma vittata e Diabrotica undecempunctata, di cui alberga l’intestino dove sverna. Xylella fastidiosa può essere acquisita da cicadellidi su numerose piante erbacee ed essere trasmessa alla vite o ad alberi. La trasmissione ha successo immediatamente dopo l’acquisizione e perdura per tutta la vita dell’insetto; in quei cicadellidi X. fastidiosa si moltiplica attaccata alla superficie del tratto iniziale del tubo digerente dove forma tappeti di proprie cellule disposte a palizzata. C’è chi ritiene verosimile che merli, storni e tordi nel corso delle loro migrazioni possano disseminare E. amylovora nutrendosi di frutti di biancospini infetti e posandosi poi sui peri ed altre piante ospiti. Infine, l’uomo può fungere da vettore a breve distanza, sporcando di batteri mani ed attrezzi, ed a grande distanza con il commercio di semi, organi di propagazione vegetativa, portainnesti e astoni.
Antonio Mazzucchi è laureato in Scienze Agrarie, indirizzo Produzione Vegetale, presso la Facoltà di Agraria di Bologna, con tesi in fitoiatria “Resistenza indotta nel pero con uso di un induttore chimico”.
E’ attualmente laureato frequentatore presso il Dipartimento di Scienze e Tecnologie Agroambientali dell’Università degli Studi di Bologna.